
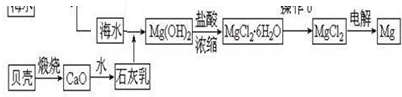
分析 Ⅰ、海水加入石灰乳沉淀镁离子生成氢氧化镁沉淀,在盐酸溶液中浓缩蒸发得到结晶水合物,氯化氢气流中加热失去结晶水得到固体氯化镁,电解熔融氯化镁得到镁,
(1)向海水中加入石灰乳后反应生成氢氧化镁沉淀和氯化钙,石灰乳不能写成离子形式;
(2)从海水中制取镁主要存在以下的转化过程:MgCl2 $\stackrel{石灰乳}{→}$Mg(OH)2 $\stackrel{盐酸蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{HCl气流中加热}{→}$MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg,利用此过程所涉及的反应和相关信息得出正确结论;
Ⅱ、(1)原电池工作时,铝为负极,被氧化,电极方程式为Al-3e-=Al3+;
(2)Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,引发铝热反应是用铝热剂的上面加少量KClO3,中间插上镁条并将其点燃,氧化铁和铝之间发生反应生成金属铁和氧化铝,反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=0.15mol,根据化学方程式计算.
解答 解:Ⅰ、(1)向海水中加入石灰乳后反应生成氢氧化镁沉淀和氯化钙,石灰乳不能写成离子形式,反应的离子方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,
故答案为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+;
(2)a、原料来源于海水,故原料来源丰富,故a正确;
b、镁是很活泼的金属,可用电解熔融氯化镁的电解法制得,电解氯化镁溶液不能得到金属镁,故b错误;
c、①为分解反应和化合反应,②为复分解反应,③为复分解反应,④为分解反应,整个变化过程中无置换反应,故c错误,
故答案为:bc;
Ⅱ、(1)负极发生氧化反应,Al失去电子生成铝离子,电极反应式为:Al-3e-═Al3+,原电池工作时,电子从负极经外电路流向正极,
故答案为:Al-3e-=Al3+;
(2)Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3═2Fe+Al2O3,引发铝热反应的实验操作是在铝热剂的上面加少量KClO3,中间插上镁条并将其点燃,
故答案为:在铝热剂的上面加少量KClO3,中间插上镁条并将其点燃;
(3)铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) 0.15mol
n(Al)=0.1mol,
m(Al)=27g/mol×0.1mol=2.7g,
ω(Al)=$\frac{2.7g}{10.8g}$×100%=25%,
故答案为:25%.
点评 本题考查铝热反应以及化学方程式的计算,题目难度中等,本题注意铝热反应的原理,注意相关方程式的书写以及物质的量应用于化学方程式的计算方法.


科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:选择题
科学家已发现一种新型氢分子,其化学式为H3,在相同条 件下,等质量的H3和H2有相同的是( )
件下,等质量的H3和H2有相同的是( )
A.原子数 B.分子数 C.体积 D.物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )| A. | 化合物A的分子式为P2O3 | |
| B. | 化合物A是磷酸的酸酐 | |
| C. | 化合物A是磷元素的最高价氧化物 | |
| D. | 化合物A中每个原子最外层都达到8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2分子中有一个σ键,2个π键 | |
| B. | 气体单质中,一定有σ键,可能有π键 | |
| C. | 通常,π键比σ键电子云重叠程度大,形成的共价键更牢固 | |
| D. | 两个原子间形成共价键时,σ键的数目取决于未成对电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com