
 $→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+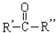
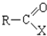 +H2O→R-COOH+HX
+H2O→R-COOH+HX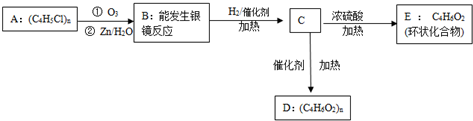
 、
、 ;
; +nH2O.
+nH2O.分析 高分子化合物(C4H5Cl)n跟臭氧反应,再在锌粉存在下水解,说明A中含有碳碳双键,B能发生银镜反应说明含有醛基,B与氢气加成生成含有醇羟基的C,C在浓硫酸的作用下发生酯化反应生成五元环酯E,说明C中还含有羧酸,羧酸与氢气不加成,说明B中含有羧酸,根据信息羧酸分子中羧基上的羧基被卤元素原子取代后的生成物为酰卤,酰卤极易与水反应,所以高分子化合物(C4H5Cl)n为 ,跟臭氧反应,再在锌粉存在下水解,B为OHCCH2CH2COOH,与氢气反应生成C为HOCH2CH2CH2COOH,C发生自身酯化反应,所以E为:
,跟臭氧反应,再在锌粉存在下水解,B为OHCCH2CH2COOH,与氢气反应生成C为HOCH2CH2CH2COOH,C发生自身酯化反应,所以E为: ,C发生缩聚反应,所以D
,C发生缩聚反应,所以D ,据此分析解答.
,据此分析解答.
解答 解:高分子化合物(C4H5Cl)n跟臭氧反应,再在锌粉存在下水解,说明A中含有碳碳双键,B能发生银镜反应说明含有醛基,B与氢气加成生成含有醇羟基的C,C在浓硫酸的作用下发生酯化反应生成五元环酯E,说明C中还含有羧酸,羧酸与氢气不加成,说明B中含有羧酸,根据信息羧酸分子中羧基上的羧基被卤元素原子取代后的生成物为酰卤,酰卤极易与水反应,所以高分子化合物(C4H5Cl)n为 ,跟臭氧反应,再在锌粉存在下水解,B为OHCCH2CH2COOH,与氢气反应生成C为HOCH2CH2CH2COOH,C发生自身酯化反应,所以E为:
,跟臭氧反应,再在锌粉存在下水解,B为OHCCH2CH2COOH,与氢气反应生成C为HOCH2CH2CH2COOH,C发生自身酯化反应,所以E为: ,C发生缩聚反应,所以D
,C发生缩聚反应,所以D ,
,
(1)根据上面的分析可知,A为 ,E为
,E为 ,
,
故答案为: ;
; ;
;
(2)C为HOCH2CH2CH2COOH,C中官能团的名称是羟基和羧基,A的单体为C4H5Cl,名称为2-氯-2-丁烯,
故答案为:羟基和羧基;2-氯-2-丁烯;
(3)B为OHCCH2CH2COOH,B的核磁共振氢谱中峰面积之比为 1:2:2:1,快速、微量、精确测定C的相对分子质量的方法是用质谱仪测量,
故答案为:1:2:2:1;用质谱仪测量;
(4)B为OHCCH2CH2COOH,B发生银镜反应的化学方程式为OHCCH2CH2COOH+2Ag(NH3)2OH$\stackrel{△}{→}$NH4OOCCH2CH2COONH4+H2O+2Ag↓+2NH3 ,
故答案为:OHCCH2CH2COOH+2Ag(NH3)2OH$\stackrel{△}{→}$NH4OOCCH2CH2COONH4+H2O+2Ag↓+2NH3;
(5)根据上面的分析可知,C→E的反应类型为酯化反应,C转化为D的化学方程式为nHOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$ +nH2O,
+nH2O,
故答案为:酯化反应;nHOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$ +nH2O;
+nH2O;
(6)C为HOCH2CH2CH2COOH,根据条件①能与金属钠反应,说明有羟基或羧基,②能发生水解反应且水解的中性产物中只有一个官能团,说明有酯基,且水解生成的醇中只有一个羟基,则符合条件的C的同分异构体为HOCOOCH2CH2CH3、HOCH2COOCH2CH3、HOCH2CH2COOCH3、HOCH(CH3)COOCH3、HOCOOCH(CH3)2,共有5种,
故答案为:5;HOCOOCH2CH2CH3、HOCH2COOCH2CH3、HOCH2CH2COOCH3、HOCH(CH3)COOCH3、HOCOOCH(CH3)2 (其中两种).
点评 本题考查有机物推断、有机反应方程式的书写,题目难度中等,试题涉及酯、醇、醛、酸之间的转化,试题侧重基础知识的考查,培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
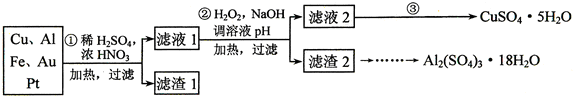
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
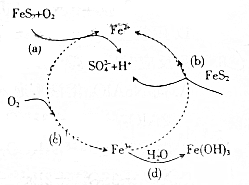 黄铁矿(主要成分为FeS2)是生产硫酸的原料,回答下列问题:
黄铁矿(主要成分为FeS2)是生产硫酸的原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1 mol•L-1 FeCl3溶液,含有Fe3+的数目为NA个 | |
| B. | 标准状况下,22.4L丙烷中碳碳共价键数目为2NA | |
| C. | 1L0.5 mol•L-1 氨水溶液中含有0.5NA个OH- | |
| D. | 室温下H2O2分解得到16 g O2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 二者在一定条件下可相互转化 | |
| D. | 与盐酸反应得到等质量CO2,用NaHCO3质量比Na2CO3要多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ($\frac{b}{A}$)(A-N)mol | B. | ($\frac{b}{A}$)(A-N+m)mol | C. | $\frac{b}{A+m}$(A-N)mol | D. | $\frac{b}{A+m}$(A-N+m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
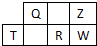 短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )
短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )| A. | Q、Z、W可形成三原子直线型分子 | |
| B. | Z、R两元素气态氢化物的沸点:R>Z | |
| C. | Z、Q两元素的气态氢化物中键能大小:Z>Q | |
| D. | T、W两元素组成的化合物不能通过水溶液中的离子反应制取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com