
下列关于化合价的说法正确的是()
| A. | 在Na2O中,钠原子显+1价,氧原子显﹣2价 | |
| B. | 在O2中,氧元素显﹣2价 | |
| C. | 非金属元素在化合物中总显负价 | |
| D. | 一种元素在同一种化合物中,可能有几种化合价 |
| 常见元素的化合价. | |
| 分析: | 根据元素化合价的实质,化合物中各种元素的化合价代数和为零,单质中元素化合价为零进行解答. |
| 解答: | 解:A、由化合价的定义可知,化合价是元素的一种重要性质,它只有在化学反应中才能表现出来,故在Na2O中,钠元素显+1价,氧元素显﹣2价,故A错误; B、单质中元素的化合价为0价,故B错误; C、从所学过的化学反应知,非金属元素在与氢气、金属化合时显负价,在与氧气反应中显正价,如H2S、Na2S中,硫元素显﹣2价;SO2、SO3中,硫元素显+4、+6价,故C错误; D、在NH4NO3中,氮元素显出两种化合价:3价和+5价;在Fe3O4中,铁元素也显出两种化合价:+2价和+3价,故D正确,故选D. |
| 点评: | 本题主要考查的我是元素的化合价,本题较简单,掌握元素的化合价规律是解决有关化合价问题的关键. |


科目:高中化学 来源: 题型:
下列离子方程式中,书写正确的是 ( )
A . 弱酸酸式盐NaHB在水溶液中水解:HB–+H2O H3O++B2–
H3O++B2–
B . 电解饱和食盐水:C1-+2H2O H2↑+Cl2↑+OH-
H2↑+Cl2↑+OH-
C . 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH-
D . FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
在科学史上中国有许多重大的发明和发现,为世界现代物质文明奠定了基础.以下发明或发现属于化学史上中国对世界重大贡献的是()
①造纸 ②印刷技术 ③火药④指南针 ⑤炼铜、炼铁、炼钢 ⑥合成有机高分子材料 ⑦人工合成牛胰岛素 ⑧提出原子﹣﹣分子论学说.
| A. | ①②③④⑧ | B. | ①③⑤⑦ | C. | ②④⑥ | D. | ⑤⑥⑦⑧2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在20℃时一刚性容器内部有一不漏气且可滑动的活塞将容器分隔成左、右室两室.左室充入N2,右室充入H2和O2,活塞正好停留离左端1/5处(如图a)然后点燃引爆H2和O2混合器,活塞先左弹(设容器不漏气),恢复至原来温度,活塞恰好停在中间(如图b),水蒸气的体积可忽略,则反应前H2和O2的体积比可能是()
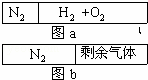
| A. | 7:1 | B. | 1:3 | C. | 1:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
| A. | 某物质中含有一种元素,则该物质一定是纯净物 | |
| B. | 金刚石和石墨之间的转变一定是化学变化 | |
| C. | 不同物质其相对分子质量一定不同 | |
| D. | 不同的原子可相互组合成复杂的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是()
| A. | 铁和足量稀硝酸反应 Fe+2H+═Fe2++H2↑ | |
| B. | 氯化铁溶液滴入沸水 Fe3++3H2O | |
| C. | 硝酸银溶液中滴入食盐水 Cl﹣+Ag+═AgCl↓ | |
| D. | 氯气通入烧碱溶液 Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中的离子,能在溶液中大量共存的是()
| A. | Na+、Mg2+、Cl﹣、OH﹣ | B. | H+、Ca2+、CO32﹣、NO3﹣ | |
| C. | Cu2+、K+、SO42﹣、NO3﹣ | D. | Na+、HCO3﹣、OH﹣、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的稳定性为H2T<H2R B.单质与稀盐酸反应的剧烈程度为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置来制取乙酸乙酯。试回答下列问题:
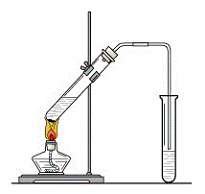 (1)写出由CH3COOH与C2H518OH制取乙酸乙酯的化学反应方程式 ;该反应属____反应。
(1)写出由CH3COOH与C2H518OH制取乙酸乙酯的化学反应方程式 ;该反应属____反应。
(2)该反应需加入一定量的浓硫酸,则浓硫酸的主要作用是 。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 (填操作名称);主要使用的玻璃仪器是 。(答仪器的名称)
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化成生成物,反应一段时间后,达到了反应的限度,即达到化学平衡状态。下列描述能说明乙醇与乙酸的反应已 达到化学平衡状态的有(填序号) 。
达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应速率与逆反应速率相等
⑤反应混合物中各物质的浓度不再 变化
变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com