
 ,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为
,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为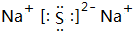 ,化合物中的化学键属于离子键.
,化合物中的化学键属于离子键. 分析 A、B、c三种元素为短周期元素.A元素的阴离子不能被任何氧化剂氧化,A元素的非金属性最强,故A为F元素;1mo1B单质能从盐酸中置换出3g氢气,B为金属元素,氢气的物质的量为$\frac{3g}{2g/mol}$=1.5mol,根据电子转移守恒,反应中B的化合价为$\frac{1.5mol×2}{1}$=+3,此时B转变为与Ne原子具有相同电子层结构的离子,则B为Al元;C元素有3个电子层,且最外电子层比L电子层少2个电子,最外层电子数为8-2=6,则C为S元素,与Na反应后生成物为Na2S.
解答 解:A、B、c三种元素为短周期元素,其中:
A元素的阴离子不能被任何氧化剂氧化,A元素的非金属性最强,故A为F元素,该离子为F-,离子结构示意图为 ;
;
1mo1B单质能从盐酸中置换出3g氢气,B为金属元素,氢气的物质的量为$\frac{3g}{2g/mol}$=1.5mol,根据电子转移守恒,反应中B的化合价为$\frac{1.5mol×2}{1}$=+3,此时B转变为与Ne原子具有相同电子层结构的离子,则B为Al元,最高价氧化物的对应水化物的化学式为Al(OH)3;
C元素有3个电子层,且最外电子层比L电子层少2个电子,最外层电子数为8-2=6,则C为S元素,与Na反应后生成物为Na2S,电子式为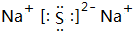 ,含有离子键,
,含有离子键,
故答案为: ;F-;Al;Al(OH)3;S;
;F-;Al;Al(OH)3;S;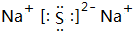 ;离子键.
;离子键.
点评 本题考查结构性质位置关系应用,难度不大,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝:中和过多胃酸 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 氢氧化钡:胃部透视 | D. | 医用碘酒:人体补碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com