
(1)熔化时不需要破坏化学键的是_________;熔化时需要破坏共价键的是_________;熔点最高的是_________;熔点最低的是_________。
(2)既有离子键又有极性共价键的物质是_________。
(3)由极性键构成的非极性分子是_________。
(4)可溶于CCl4的有_________。
解析:(1)晶体熔化时需要克服晶体中粒子间的结合力,原子晶体要破坏共价键,离子晶体破坏离子键,金属晶体破坏金属键,分子晶体只需破坏范德瓦尔斯力。SiO2为原子晶体,熔点最高,干冰是CO2晶体为分子晶体,但CO2常温为气体,所以CO2熔点最低。
(2)在NH4Cl中,![]() 与Cl-为离子键,
与Cl-为离子键,![]() 中N与H之间为极性共价键,在NaNO3中Na+与
中N与H之间为极性共价键,在NaNO3中Na+与![]() 为离子键,
为离子键,![]() 中N与O之间为极性共价键。
中N与O之间为极性共价键。
(3)分子的极性与键的极性和分子的空间构型有关,CO2分子中,C与O之间为极性共价键,分子为直线型结构对称,为非极性分子。
(4)根据“相似相溶原理”,CCl4为非极性溶剂,易溶解非极性分子。
答案:(1)EF A A E (2)CD (3)E (4)EF


科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
| 化学键 | F-D | F-F | B-B | F-B | C═D | D═D |
| 键能/kJ?mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
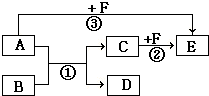 有A、B、C、D、E、F六种物质,它们之间相互转化的关系如图所示(反应条件及部分产物未标出).
有A、B、C、D、E、F六种物质,它们之间相互转化的关系如图所示(反应条件及部分产物未标出).
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com