
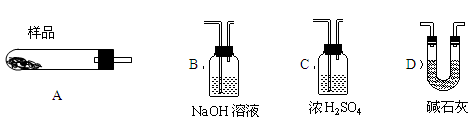
用于分离或提纯物质的方法有:A蒸馏(分馏);B萃取;C过滤;D重结晶;E分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙 ;
(2)分离四氯化碳与水的混合物 ;
(3)分离汽油和煤油 ;
(4)分离碘水中的碘单质 ;
(5)KNO3晶体中含有少量食盐 。
(1)C (2)E (3)A (4)BE (5)D
解析试题分析:(1)淀粉液中含有泥沙,泥沙不溶解于水,淀粉溶解,故采用过滤法分离。(2)分离四氯化碳与水的混合物它们是互不相溶的液体,可采用分液法分离。(3)分离汽油和煤油 二者互溶且沸点不同,可采用蒸馏方法分离。(4)分离碘水中的碘单质 可以利用碘单质在四氯化碳中的溶解度比在水中的大,水和四氯化碳互不相溶的性质采用萃取然后分液的方法分离。(5)KNO3晶体中含有少量食盐利用食盐的溶解度受温度的影响变化不大,而KNO3的溶解度受温度的影响变化较大,先把固体溶解在水中,配成高温下的饱和液,然后降低温度,硝酸钾大部分结晶析出,杂质氯化钠仍然溶解在水中,用结晶、重结晶的方法分离提存。所以正确选项为:(1)C (2)E (3)A (4)BE (5)D
考点:考查分离或提纯物质的方法的知识。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:填空题
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品CuAlO2的工艺如下:(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)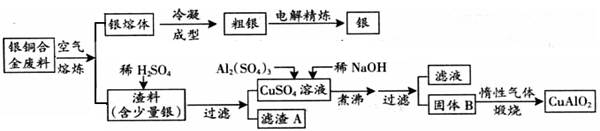
(1)铜的核外电子排布式为 .
(2)电解精炼银时,阴极反应式为 滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 .
(3)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,最后将得不到CuAlO2 ,写出因NaOH过量引起的反应的离子方程式 .
(4)若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),则滤液中的阳离子有 .
(5)完成上述煅烧过程中一个反应的化学方程式:
CuO + Al2O3 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写).
(6)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某白色粉末由碳酸钠、硝酸镁、硫酸铜、氯化钾、氯化铵中的一种或几种组成。为了检验它们所含的物质,做了以下实验。①取部分粉末,加水溶解,得无色溶液。将所得溶液分成两份,分别进行实验;②在第一份溶液中滴加足量稀盐酸,有气泡产生,继续往反应后的溶液中滴加AgNO3溶液有白色沉淀生成;③在第二份溶液中滴加氢氧化钠溶液并加热,将湿润的红色石蕊试纸放在试管口,试纸变蓝。由此可判断固体混合物中肯定含 (写化学式,下同),肯定没有 ,可能含有 。对可能有的物质,可采用 来检验,如果含有该物质,其现象是 。步骤③中有关的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选作鉴别的试剂有(填编号,可多选)_________。
A.BaCl2溶液 B.Mg(NO3)2溶液 C.Na2CO3溶液
②鉴别反应的离子方程式:_________________________。
(2)饱和碳酸钠溶液、澄清石灰水
①可选用鉴别的试剂有(填编号,可多选)____。
a.盐酸 b.NaCI c.硝酸 d.BaCl2溶液
②依次写出鉴别中有明显现象的反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
方案乙:
(1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________ _ ______。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3=2 CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+=Fe 3+ + Ce3+
计算上述样品中CuCl的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了达到下列表格中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 | 试剂及方法 |
| 证明明矾水溶液呈酸性 | |
| 鉴别甲烷与乙烯 | |
| 除去MgO中含有的Al2O3 | |
| 鉴别乙醇和乙醛 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有 、 (填化学式)。
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使 _,而水的软化是________。
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为 ;电渗析法净化水时,使离子通过半透膜的推动力是 。
(5)某天然水中 、
、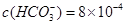
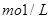 。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。
。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: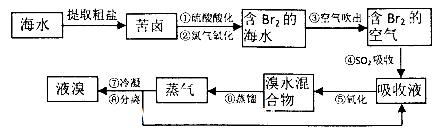
(1)氯元素在周期表中位于_______ 周期_______族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是________ 。
(3)步骤④利用了SO2的还原性,反应的离子方程式为_________ __。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,请解释原因____________________________.
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com