
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①⑥⑦⑧ |
分析 由固态变为液态叫熔化,由液态变为固态叫凝固;由气态变为液态叫液化,由液态变为气态叫汽化;物质由气态直接变为固态叫凝华,物质由固态直接变为气态叫升华.
六种物态变化过程中,都伴随着吸热或放热;其中放出热量的物态变化有:凝固、液化、凝华;吸热的有:熔化、汽化、升华,
常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:①钢铁生锈发生的是氧化还原反应,反应过程中放热,
②酸碱中和反应属于放热反应,
③浓硫酸稀释溶解干燥放热,
④固体氢氧化钠溶于水,溶液温度升高,过程中放热,
⑤H2在 Cl2中燃烧反应属于放热反应,
⑥液态水变成 水蒸气需要吸收热量,
⑦NH4Cl 晶体与 Ba(OH)2•8H2O 混合搅拌发生的反应为吸热反应,
⑧工业制取水煤气是碳和水蒸气高温反应,反应属于吸热反应,
①②③④⑤过程中放热,
故选A..
点评 本题考查放热反应、生活中物态变化现象及吸热和放热情况的判断,题目难度不大,掌握中学化学中常见的吸热或放热的反应、六种物态变化的状态变化,吸热和放热情况是解答此题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 三者的单质直接与O2反应都能生成两种以上的氧化物 | |
| B. | CO2、NO2、SO2都能与H2O发生化合反应 | |
| C. | CO2、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 三种元素在自然界中既有游离态又有化合态 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
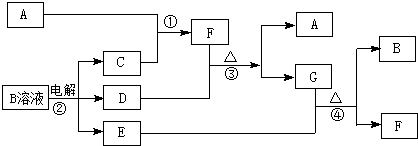
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
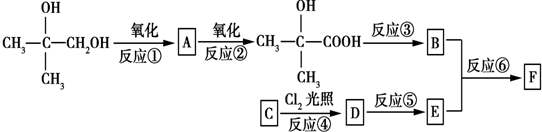
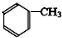 ,反应③的条件是浓硫酸、加热.
,反应③的条件是浓硫酸、加热.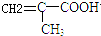 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$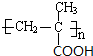 .
.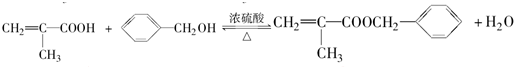 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
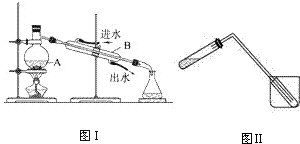
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com