
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由同种元素组成的物质是单质,由多种元素组成的物质是混合物 | |
| C. | 酸性氧化物一定是非金属氧化物,非金属氧化物一定是酸性氧化物 | |
| D. | 溶液、胶体、浊液一定都是混合物 |
分析 A、金属氧化物有酸性氧化物、碱性氧化物、过氧化物和两性氧化物等;
B、多种元素组成的物质可能是纯净物;
C、非金属氧化物不一定是酸性氧化物;
D、两种或多种物质构成的是混合物.
解答 解:A、金属氧化物有酸性氧化物、碱性氧化物、过氧化物和两性氧化物等,如Al2O3属于两性氧化物,不是碱性氧化物,故A错误;
B、多种元素组成的物质可能是纯净物,如HClO有三种元素组成,属于纯净物,故B错误;
C、非金属氧化物有酸性氧化物和不成盐氧化物,如CO属于不成盐氧化物,故C错误;
D、两种或多种物质构成的是混合物,溶液、胶体、浊液属于分散系,一定都是混合物,故D正确.
故选D.
点评 本题考查氧化物的分类和性质、混合物,题目难度不大,注意两性氧化物和不成盐氧化物的性质,侧重于考查学生对基础知识的应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
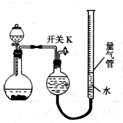 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ①④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | Ⅰ | Ⅱ |
| A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
| B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
| C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
| D | 少量NaHCO3溶液滴入澄清石灰水中 | 少量NaOH溶液滴入Ca(HCO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
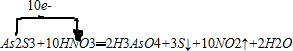 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液:MnO4- Na+ I- Mg2+ | |
| B. | 含有0.1mol/L Fe3+ 的溶液中:Na+ Ca2+ SCN- SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32- SO42- Na+ NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+ Cl- NO3- Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
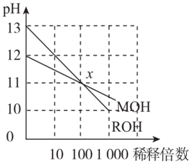
| A. | ROH是一种强碱,MOH是一种弱碱 | |
| B. | 等浓度的MOH与盐酸反应,所得溶液呈中性,则V(MOH)>V(盐酸) | |
| C. | 在x点,c(M+)=c(R+) | |
| D. | 稀释前,c(ROH)=10c(MOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com