
| A. | 二溴乙烷: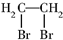 | B. | 3-乙基-1-丁烷: | ||
| C. | 2,2,3-三甲基戊烷: | D. | 2-甲基-2,4-己二烯: |
分析 A、卤代烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
B、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
C、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
D、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置.
解答 解:A、卤代烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,故两个溴原子分别在1号和2号碳原子上,故为1,2-二溴乙烷,故A错误;
B、烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,为戊烯,从离支链近的一端给主链上碳原子编号,故在3号碳原子上有一个甲基,在1号和2号碳原子间有碳碳双键,故名称为3-甲基-1-戊烯,故B错误;
C、烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,为戊烷,从离支链近的一端给主链上碳原子编号,当两端离支链一样近时,要从支链多的一端给主链上的碳原子编号,故名称为2,2,4-三甲基戊烷,故C错误;
D、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有6个碳原子,故为己二烯,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故在2号碳原子上有一个甲基,在2号和3号碳原子间、4号和5号碳原子间各有一条双键,故名称为2-甲基-2,4-己二烯,故D正确;
故选D.
点评 本题考查了烷烃、烯烃和卤代烃的命名,难度不大,应注意的是二烯烃的命名方法.


科目:高中化学 来源: 题型:解答题
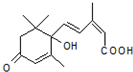 农艺师对盆栽鲜花施用了S-诱抗素剂(分子结构如图),以使鲜花按时盛开.
农艺师对盆栽鲜花施用了S-诱抗素剂(分子结构如图),以使鲜花按时盛开.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨易液化,因此可用来作制冷剂 | B. | 氨水显弱碱性,能使酚酞溶液变红 | ||
| C. | 氨极易溶于水,因此氨水比较稳定 | D. | 氨极易溶于水,因此可作喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
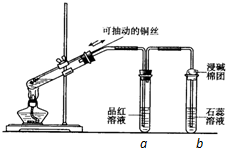 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中,阴离子个数等于NA | |
| B. | 标准状况下,22.4L正戊烷完全燃烧产生5NA个CO2分子 | |
| C. | 乙烯和丙烯的混合气体14g中,含有的共价键数目为3 NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com