
| H | + 4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
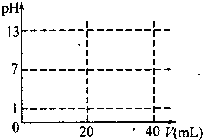 (2012?成都模拟)溶液中的化学反应大多是离子反应.根据要求回答下列问题.
(2012?成都模拟)溶液中的化学反应大多是离子反应.根据要求回答下列问题.查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市朝阳区高二下学期期末统一考试化学试卷(带解析) 题型:问答题
(4分)简答题
(1)盐碱地因含较多的 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有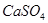 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释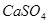 的作用 。
的作用 。
(2)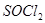 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将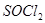 与
与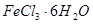 混合并加热,可得到无水
混合并加热,可得到无水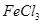 ,得到无水
,得到无水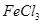 的化学方程式为 。
的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013届北京市朝阳区高二下学期期末统一考试化学试卷(解析版) 题型:简答题
(4分)简答题
(1)盐碱地因含较多的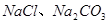 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有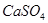 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释 的作用
。
的作用
。
(2)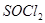 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将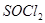 与
与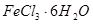 混合并加热,可得到无水
混合并加热,可得到无水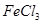 ,得到无水
,得到无水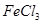 的化学方程式为
。
的化学方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com