
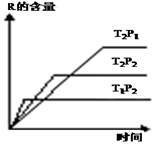
 在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )
在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )| A. | 正反应放热,L是气体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L不是气体 | D. | 正反应吸热,L不是气体 |
分析 由图中上方两条线可知,温度相同时压强不同,P2先达到平衡状态,则P2>P1,且P2对应的R的含量低;
由图中下方两条线可知,压强相同时温度不同,T1先达到平衡状态,则T1>T2,且T1对应的R的含量低,以此来解答.
解答 解:由图中上方两条线可知,温度相同时压强不同,P2先达到平衡状态,则P2>P1,且P2对应的R的含量低,即增大压强平衡逆向移动,可知L应为气体;
由图中下方两条线可知,压强相同时温度不同,T1先达到平衡状态,则T1>T2,且T1对应的R的含量低,即升高温度平衡逆向移动,可知正反应为放热反应,
故选A.
点评 本题考查化学平衡的影响因素及图象,为高频考点,把握图中温度、压强的比较方法及对平衡的移动的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
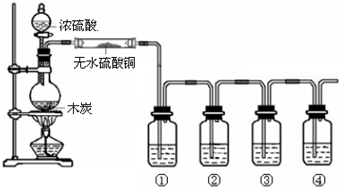
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-离子的结构示意图: | B. | 硫酸铝的化学式:AlSO4 | ||
| C. | H2O2中O的化合价为-2价 | D. | 钾原子的原子结构示意图: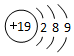 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
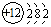 ,O2-结构示意图:
,O2-结构示意图: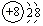 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
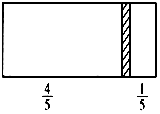 一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )| A. | 右边与左边分子数之比为4:1 | |
| B. | 右侧CO的质量为5.6 g | |
| C. | 右侧气体密度是相同条件下氢气密度的14倍 | |
| D. | 若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
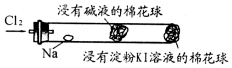 某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃| A. | 钠着火燃烧产生苍白色火焰和白烟 | |
| B. | 白烟是氯化钠微晶分散在空气中形成 | |
| C. | 玻管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境 | |
| D. | 根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com