
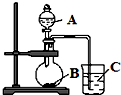
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.分析 (1)①根据元素周期律可知,同一周期,从左到右,失电子能力减弱,元素金属性逐渐减弱;
②先判断金属性强弱,然后根据金属性越强,单质与水反应越剧烈,四种金属中钾的金属性最强,则反应最剧烈的烧杯里金属是钾;
③钠与水反应生成氢氧化钠和氢气,根据离子方程式的书写方法书写;
④反应现象不明显,说明反应速率小,根据影响速率的因素分析,镁能与热水反应,铝与水不反应,但二者均能与酸反应,则要想达到实验的目的,可以把把烧杯中的冷水换成热水或把把烧杯中的冷水换成盐酸;
(2)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,为硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答.
解答 解:(1)①根据元素周期律可知甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性逐渐减弱,
故答案为:逐渐减弱;
②金属性:K>Na>Mg>Al,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是D,
故答案为:D;
③钠与水反应生成氢氧化钠和氢气,则反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
④反应现象不明显,说明反应速率小,升高温度可以加快速率,所以把冷水换为热水,把水换为盐酸增大了溶液中氢离子的浓度,可以加快速率,
故答案为:BC;
(2)①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠或硅酸钾,
故答案为:HNO3;Na2SiO3(或K2SiO3);
②烧瓶中发生硝酸与碳酸钙的反应,方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
故答案为:2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,以及较强酸制备较弱酸原理,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,
故答案为:氮>碳>硅.
点评 本题考查了物质性质实验方案的设计,侧重于学生的分析能力和实验能力的考查,本题将元素及其化合物、元素周期律与实验知识结合起来,具有较强的综合性,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 | |
| B. | 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O?H++OH-逆向移动,c(H+)降低 | |
| C. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入 0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| D. | 常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 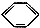 +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$ Br+HBr Br+HBr | |
| D. | CH2═CH2+Br2→CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述条件下,SO2可能100%的转化为SO3 | |
| B. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2与SO3的浓度保持不变 | |
| D. | 为了提高SO2的转化率,可以适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100W}{36a}$×100% | B. | $\frac{W}{36a+W}$×100% | C. | $\frac{W}{3600a+W}$×100% | D. | $\frac{100W}{36a+W}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
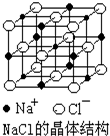 NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )
NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )| A. | $\frac{0.585}{4{a}^{3}ρ}$ | B. | $\frac{5.85}{8{a}^{3}ρ}$ | C. | $\frac{58.5}{2{a}^{3}ρ}$ | D. | $\frac{58.5}{{a}^{3}ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.
=$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com