
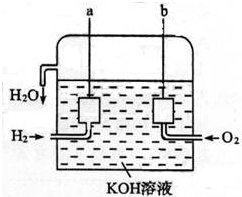
分析 氢氧碱性燃料电池,负极发生氧化反应,氢气在负极放电,a为负极,电极反应式为H2+2OH--2e-=2H2O,正极发生还原反应,氧气在正极放电,b为正极,电极反应式O2+2H2O+4e-=4OH-,计算生成350g的水放出的热量,根据该电池的能量转化率等于实际产生的热量和理论产生热量的比值,据此计算回答.
解答 解:(1)氢氧碱性燃料电池,通燃料的电极a是负极,发生氧化反应,氢气在负极放电电极反应式为H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O;
(2)氢氧碱性燃料电池,通氧气的电极b是正极,正极发生还原反应,电极反应式O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(3)1度电=1kW•h=3600kJ,则电池生成350gH2O可发出能量3600kJ,则生成1mol水放出的能量为$\frac{\frac{3600}{350}}{18}$=185kJ,则电池的能量转化率为$\frac{185}{286}$×100%=64.7%,故答案为:64.7%.
点评 本题考查学生燃料电池的工作原理以及应用知识,属于综合知识的考查,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
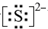 ;化合物ba3的结构式为
;化合物ba3的结构式为 .
.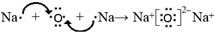 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
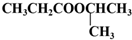 的合理可行的流程图,无机物质可任意选用.
的合理可行的流程图,无机物质可任意选用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、CO32-、Cl- | B. | K+、H+、Cl-、SO42- | ||
| C. | Na+、Cu2+、SO42-、OH- | D. | H+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定相同浓度H2CO3、H2SO4两溶液的pH | 比较碳、硫的非金属强弱 |
| D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 方法 |
| A | 溴苯(溴) | CCl4 | 分液 |
| B | NH3(H2O) | 浓硫酸 | 洗气 |
| C | 乙烷(乙烯) | 溴水 | 洗气 |
| D | CO2(SO2) | Na2CO3饱和溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com