
���� ��1�����ö����������Ȼ�����������ԭ��Ӧ�ɱȽϻ�ԭ��ǿ�������������Ȼ�����Һ������������������Σ�֤���˷�Ӧ������Ҫ��֤��Һ����������ɣ������Ȼ�����Һ���������鷴Ӧ���������Ƿ���ڣ�
��2���ⶨ���ֱ��ʵ�Na2SO3������Ʒ��Na2SO3�ĺ�����
������������ⷢ��������ԭ��Ӧ���������������
������Na2SO3+I2+H2O=Na2SO4+2HI���м���Na2SO3���ʵ�����ע����Һ����仯����100ml��Һ���������Ƶ����ʵ������õ��������Ƶĺ�����
��� �⣺��1��������������Ȼ�����������ԭ��Ӧ�ɱȽϻ�ԭ��ǿ��������Ƽ�ʵ��ΪȡԼ2mLSO2�ı�����Һ���Թ��У��μ�3��5���Ȼ�����Һ��ҡ�ȣ��μ�2��3��KSCN��Һ����Һ����죬�ٵμӼ���BaCl2��Һ��������ɫ������˵����ԭ�� SO2��Fe2+��
�ʴ�Ϊ��ȡԼ2mLSO2�ı�����Һ���Թ��У��μ�3��5���Ȼ�����Һ��ҡ�ȣ��μ�2��3��KSCN��Һ����Һ����죬�ٵμӼ���BaCl2��Һ��������ɫ������˵����ԭ�� SO2��Fe2+��
��2���ٵ����������������������ⷢ��������ԭ��Ӧ���ζ��յ�ʱ����Һǡ������ɫ����ɫ����30����ɫ����ȥ��
�ʴ�Ϊ����Һǡ������ɫ����ɫ����30����ɫ����ȥ��
��20.00mL��ˮ�к�������ʵ���=20.00��10-3L��0.01mol/L=2.000��10-4mol��������ʵ���Ϊx��
Na2SO3+I2+H2O=Na2SO4+2HI
1 1
x 2.000��10-4mol
x=2.000��10-4mol��
10.00mL��n��Na2SO3��=2.000��10-4mol��
100mL��n��Na2SO3��=2.000��10-3mol��
m��Na2SO3��=2.000��10-3mol��126g/mol=0.252g��
��أ�Na2SO3��=$\frac{0.252g}{ag}$��100%=$\frac{0.252}{a}$��100%=$\frac{25.2}{a}%$��
�ʴ�Ϊ��$\frac{25.2}{a}%$��
���� ���⿼������ʵ�鷽������ƺ����ʺ����IJⶨ��Ϊ��Ƶ���㣬����������ԭ��Ӧԭ����ʵ�鼼��Ϊ���Ĺؼ������ط�������������������ʵ���������ۺϿ��飬��Ŀ�Ѷ��еȣ�


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��һ���Ե��--ͭп��صļ���װ�ã�
��ͼ��һ���Ե��--ͭп��صļ���װ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
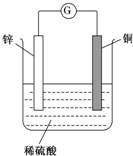 ��ͼ��ʾ����п��ͭͨ����������������ϡ�����У�
��ͼ��ʾ����п��ͭͨ����������������ϡ�����У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
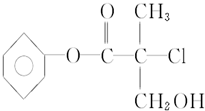 ij�л���X��ũҩ�����е�һ���м��壬��ṹ��ʽ��ͼ��
ij�л���X��ũҩ�����е�һ���м��壬��ṹ��ʽ��ͼ��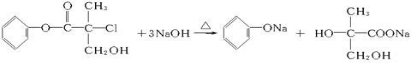 +NaCl+H2O��
+NaCl+H2O��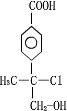 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ó�ϫ���磬����ѧ��ת��Ϊ���� | |
| B�� | ���踻����ֱ����ȡ��ˮ�е��� | |
| C�� | �ú�ˮ�е�NaCl��ȡ�ռ�ʹ��� | |
| D�� | ֻ��ʹ��ˮ�еĵ��������ܵõ��ⵥ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 13C�� 14N ��������� 1��������Ҳ���1 | |
| B�� | һ��Ԫ�ؿ����ж��ֺ��أ��м��ֺ��ؾ��м���ԭ�� | |
| C�� | ��5627Co��5727Co��5827Co��5927Co�ȼ���ԭ�ӣ�������ͬ�������壬���������ʼ�����ͬ����ѧ���ʲ�ͬ | |
| D�� | �˾۱���21H+31H��42He+10 n���������������ɣ��ñ仯�ǻ�ѧ�仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
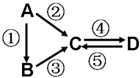 A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʣ�����֮�������µķ�Ӧ��ϵ��
A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʣ�����֮�������µķ�Ӧ��ϵ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com