
| ŹµŃéÄŚČŻ | ŹµŃéÄæµÄ | |
| A | Ļņ1mL 1%µÄNaOHČÜŅŗÖŠ¼ÓČė2mL 2%µÄCuSO4ČÜŅŗ£¬Õńµ“ŗóŌŁ¼ÓČė0.5mLÓŠ»śĪļX£¬¼ÓČČÖó·ŠŗóĪ“³öĻÖשŗģÉ«³Įµķ | ŃéÖ¤X½į¹¹ÖŠ²»ŗ¬ÓŠČ©»ł |
| B | ŌŚ»ģÓŠÉŁĮæ±½·ÓµÄ±½ÖŠµĪ¼Ó×ćĮæäåĖ®£¬³ä·ÖÕńµ“ŗó¹żĀĖ | ³żČ„±½ÖŠÉŁĮæµÄ±½·Ó |
| C | äåŅŅĶéÓėNaOHČÜŅŗ¼ÓČČÖĮ²»ŌŁ·Ö²ć£¬ĄäČ“ŗó¼ÓĻ”ĻõĖįÖĮĖįŠŌ£¬ŌŁµĪ¼ÓAgNO3ČÜŅŗ | ŃéÖ¤Ā±ĖŲŌ×ÓĪŖäåŌ×Ó |
| D | ½«ŅŅ“¼ÓėÅØĮņĖį¹²ČČÖʵƵÄĘųĢåĶØČėĖįŠŌKMnO4ČÜŅŗÖŠ | ¼ģŃéĘųĢåÖŠŗ¬ÓŠŅŅĻ© |
| A£® | A | B£® | B | C£® | C | D£® | D |
·ÖĪö A£®ÓĆŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ¼ģŃéČ©»łŹ±£¬±ŲŠėŹĒŌŚ¼īŠŌĢõ¼žĻĀ£»
B£®±½·ÓŗĶäå·¢ÉśČ”“ś·“Ӧɜ³Éäå±½£¬äå±½”¢±½ŗĶäåÄÜ»„ČÜ£»
C£®Ā±“śĢžĖ®½āŗóÉś³ÉNaX£¬ŌŚĖįŠŌĢõ¼žĻĀÓėĻõĖįŅų·“Ӧɜ³ÉAgX£¬ĄūÓĆ³ĮµķµÄŃÕÉ«æÉČ”“śĀ±ĖŲŌ×Ó£»
D£®ŅŅ“¼Ņ×»Ó·¢£¬»Ó·¢³öµÄŅŅ“¼Ņ²Äܹ»Ź¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£®
½ā“š ½ā£ŗA£®ŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ¼ģŃéČ©»łŹ±£¬±ŲŠėŹĒŌŚ¼īŠŌĢõ¼žĻĀ£¬øĆŹµŃéÖŠNaOH²»×ćµ¼ÖĀNaOHŗĶĮņĖįĶ»ģŗĻČÜŅŗ²»ŹĒ¼īŠŌ£¬ĖłŅŌŹµŃé²»³É¹¦£¬¹ŹA“ķĪó£»
B£®±½·ÓŗĶäå·¢ÉśČ”“ś·“Ӧɜ³Éäå±½£¬äå±½”¢±½ŗĶäåÄÜ»„ČÜ£¬Ó¦øĆÓĆNaOHŗĶ±½·Ó·“Ӧɜ³ÉæÉČÜŠŌµÄ±½·ÓÄĘ£¬Č»ŗó·ÖŅŗ³żČ„±½ÖŠµÄ±½·Ó£¬¹ŹB“ķĪó£»
C£®Ā±“śĢžÖŠ¼ÓČė×ćĮæNaOHĖ®ČÜŅŗ£¬¼ÓČČ£¬Ė®½āŗóÉś³ÉNaX£¬ŌŚĖįŠŌĢõ¼žĻĀÓėĻõĖįŅų·“Ӧɜ³ÉAgX£¬ĄūÓĆ³ĮµķµÄŃÕÉ«æÉČ”“śĀ±ĖŲŌ×Ó£¬¹ŹCÕżČ·£»
D£®»Ó·¢³öĄ“µÄŅŅ“¼Äܹ»Ź¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬øÉČÅĮĖŅŅĻ©µÄ¼ģŃ飬ӦøĆÓĆäåĖ®¼ģŃéŅŅĻ©£¬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²é»ÆѧŹµŃé·½°øµÄĘĄ¼Ū£¬ĪŖøßĘµæ¼µć£¬Éę¼°ÓŠ»śĪļµÄÖʱø”¢Ė®½ā”¢ĻūČ„ŹµŃé¼°²śĪļµÄ¼ģŃéµČ£¬°ŃĪÕÓŠ»śĪļµÄŠŌÖŹ¼°ŹµŃéŌĄķĪŖ½ā“šµÄ¹Ų¼ü£¬×¢ŅāŹµŃéµÄ²Ł×÷ŠŌ”¢ĘĄ¼ŪŠŌ·ÖĪö£¬ĢāÄæÄŃ¶Č²»“ó£®


 ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø
ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 15g¼×»ł£Ø-CH3£©Ėłŗ¬ÓŠµÄµē×ÓŹżŹĒ10 NAøö | |
| B£® | ±ź×¼×“æöĻĀ£¬2.24 L CHCl3µÄŌ×Ó×ÜŹżĪŖ0.5 NAøö | |
| C£® | 4.2g C3H6ÖŠŗ¬ÓŠµÄĢ¼Ģ¼Ė«¼üŹżŅ»¶ØĪŖ0.1NA | |
| D£® | ³£ĪĀĻĀ£¬14gŅŅĻ©ŗĶ±ūĻ©µÄ»ģŗĻĪļÖŠ×ÜŌ×ÓŹżĪŖ3NAøö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
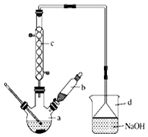 äå±½ŹĒŅ»Öֻƹ¤ŌĮĻ£¬ŹµŃéŹŅŗĻ³ÉäåĢåµÄ×°ÖĆŹ¾ŅāĶ¼¼°ÓŠ¹ŲŹż¾ŻČē±ķ£ŗ
äå±½ŹĒŅ»Öֻƹ¤ŌĮĻ£¬ŹµŃéŹŅŗĻ³ÉäåĢåµÄ×°ÖĆŹ¾ŅāĶ¼¼°ÓŠ¹ŲŹż¾ŻČē±ķ£ŗ| ±½ | äå | äå±½ | |
| ĆܶČ/g•cm-3 | 0.88 | 3.10 | 1.50 |
| ·Šµć/”ę | 80 | 59 | 156 |
| Ė®ÖŠČܽā¶Č | Ī¢ČÜ | Ī¢ČÜ | Ī¢ČÜ |
 £»×°ÖĆdµÄ×÷ÓĆĪüŹÕHBrŗĶäåÕōĘų£»·ĄÖ¹µ¹Īü£®
£»×°ÖĆdµÄ×÷ÓĆĪüŹÕHBrŗĶäåÕōĘų£»·ĄÖ¹µ¹Īü£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | S£Øg£©+O2£Øg£©=SO2£Øg£©”÷H3S£Øs£©+O2£Øg£©=SO2£Øg£©”÷H2£¬Ōņ”÷H1£¼”÷H2 | |
| B£® | Zn£Øs£©+CuSO4£Øaq£©=ZnSO4£Øaq£©+Cu£Øs£©”÷H=-216kJ•mol-1£¬Ōņ·“Ó¦×ÜÄÜĮæ£¾Éś³ÉĪļ×ÜÄÜĮæ | |
| C£® | ¼ŗÖŖC£ØŹÆÄ«•s£©=C£Ø½šøÕŹÆ•s£©”÷H£¾0£¬ŌņŹÆÄ«±Č½šøÕŹÆĪČ¶Ø | |
| D£® | ĻąĶ¬Ģõ¼žĻĀ£¬Čē¹ū1molĒāŌ×ÓĖł¾ßÓŠµÄÄÜĮæĪŖE1•1molĒā·Ö×ÓĖł¾ßÓŠµÄÄÜĮæĪŖE2£¬Ōņ2E1=E2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2µÄ×Ŗ»ÆĀŹĪŖ60% | |
| B£® | SO3µÄ²śĀŹĪŖ60% | |
| C£® | Ę½ŗāŹ±×ÜŃ¹ĒæÓėĘšŹ¼Ń¹ĒæÖ®±ČĪŖ7£ŗ8 | |
| D£® | Ę½ŗāŹ±V£ØSO2£©£ŗV£ØO2£©£ŗV£ØSO3£©=3£ŗ3£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com