
下列说法正确是的
A. 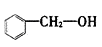 属于酚类,官能团为-OH
属于酚类,官能团为-OH
B. 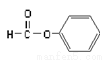 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. 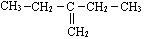 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. H2C=CH-CH=CH2的名称为:1,3-二丁烯
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次月考化学试卷(解析版) 题型:推断题
某单烯烃Q的相对分子质量为56,分子中含有支链。
(1)Q的结构简式为_____________。
(2)在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之—(用M表示)的结构简式如图: 。M的合成方法之一如下:
。M的合成方法之一如下:

请回答下列问题:
①合成M的反应中,反应I的反应类型是________,试剂II是_________。
②E的结构简式是_________。
③M与足量氢氧化钠溶液反应的化学方程式是_________________。
(3)D在一定条件下能发生缩聚反应生成高聚物,请写出D发生缩聚反应的化学方程式:__________。
(4)已知:(其中R为烃基)
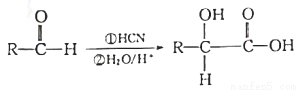
若 ,请写出符合下列条件,且与W互为同分异构体的物质的一种结构简式:_______。
,请写出符合下列条件,且与W互为同分异构体的物质的一种结构简式:_______。
a.碳骨架与W相同;
b.能发生银镜反应;
c.1 mol该物质与足量金属钠作用生成1.5 mol H2 ;
d.分子中毎个碳原子上不同时连有两个官能团
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高二下学期3月月考化学试卷(解析版) 题型:选择题
下列描述 分子结构的叙述中,正确的是
分子结构的叙述中,正确的是
A.最多有6个碳原子在一条直线上 B.该烃属于苯的同系物
C.至少有10个碳原子在同一平面上 D.所有碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
利用下列装置(部分仪器已省略),能顺利完成对应实验的是
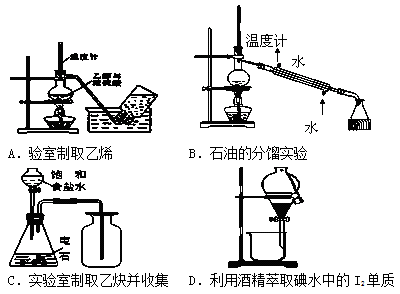
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
分子式为C5H12O,能发生催化氧化生成醛,符合此要求的醇的种类为
A. 3种 B. 4 种 C. 5 种 D. 8种
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:简答题
铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______,_________接受孤对电子对;金属铜的堆积方式为______。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________,COCl2分子中ɑ键和π键的个数比为__________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
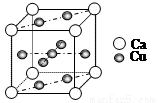
①该晶体的化学式为_________,铜和钙两种金属相比铜的熔点比钙高,其原因是_______。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
B | 向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/LZnSO4溶液;再滴2滴0.1mol/LCuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶解度(Ksp):ZnS>CuS |
C | 在稀硫酸中加入铜,再加入硝酸钠固体 | 开始无现象,后铜逐步溶解,溶液变蓝,有气泡产生 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
观察下列模型并结合有关信息, 判断有关说法正确的是
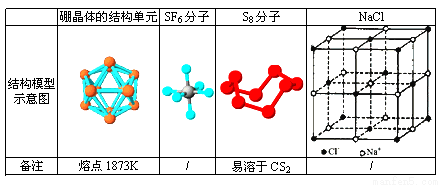
A. 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形
B. SF6是由极性键构成的分子
C. 固态硫S8属于原子晶体
D. NaCl晶体中每个Na+周围距离最近的Na+有6个
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:简答题
五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
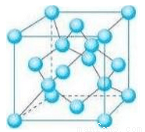
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com