
| A. | BaCl2 Na2CO3 AgNO3 盐酸 | B. | BaCl2 Na2CO3 盐酸 AgNO3 | ||
| C. | Na2CO3 盐酸 AgNO3 BaCl2 | D. | AgNO3 盐酸 BaCl2 Na2CO3 |
分析 甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,乙+丁→无色气体,说明乙和丁中的一种是碳酸钠,一种是盐酸;甲、乙、丁都能和丙反应生成沉淀,能和另外三种物质生成沉淀的是硝酸银,则丙是硝酸银;甲+乙→沉淀,甲是氯化钡,则乙是碳酸钠,丁是盐酸,据此答题.
解答 解:甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,乙+丁→无色气体,说明乙和丁中的一种是碳酸钠,一种是盐酸;甲、乙、丁都能和丙反应生成沉淀,能和另外三种物质生成沉淀的是硝酸银,则丙是硝酸银;甲+乙→沉淀,甲是氯化钡,则乙是碳酸钠,丁是盐酸,
故选A.
点评 本题考查了物质检验,物质性质的分析应用,乙+丁→无色无味气体的转化是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离氢氧化铁胶体和氯离子 | 过滤 | 胶体不能透过半透膜,离子能 |
| B | 除去乙醇中的乙酸 | 蒸馏 | 先加生石灰,利用乙醇与乙酸盐沸点相差较大 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离植物油和水的混合物 | 分液 | 二者互不相溶且沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝易氧化,但氧化铝具有保护内部铝的作用 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧化 | |
| D. | 铝不易发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电泳现象可证明胶体属于电解质溶液 | |
| B. | 胶体可以透过半透膜 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 直径介于1~100 nm之间的微粒称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. (或
(或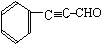 ).
). 、
、 、
、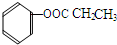 、
、 、
、 、
、 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②⑤⑥ | C. | ②③⑤ | D. | ②⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com