
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| B | 向AgI悬浊液中滴加NaCl溶液 | 不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 向KI溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈紫色 | I-还原性强于Cl- |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.镁能与氢离子反应生成氢气;
B.可能反应生成白色沉淀;
C.同一氧化还原中,还原剂的还原性大于还原产物的还原性;
D.KSCN和铁离子反应生成血红色液体,和亚铁离子不反应,氯水具有强氧化性,能氧化亚铁离子生成铁离子.
解答 解:A.镁能与氢离子反应生成氢气,无法确定是氨气,故A错误;
B.氯离子浓度大时,可能反应生成白色沉淀,故B错误;
C.氯气氧化碘离子生成碘单质,该反应中碘离子是还原剂、氯离子是还原产物,还原剂的还原性大于还原产物的还原性,所以I-的还原性强于Cl-,故C正确;
D.KSCN和铁离子反应生成血红色液体,和亚铁离子不反应,氯水具有强氧化性,能氧化亚铁离子生成铁离子,所以应该先加入KSCN然后加入氯水,防止铁离子干扰实验,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的性质、沉淀转化、还原性比较以及离子检验等知识点,侧重考查实验基本操作、物质性质,明确常见离子性质的特殊性、实验操作规范性是解本题关键,注意离子检验时要排除其它离子干扰,易错选项是D.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )| A. | 利用I、II装置制取气体(K2关闭、K1打开),可以收集H2等气体,但不能收集02、NO气体 | |
| B. | 利用II装置作简单改进(但不改变瓶口朝向)后,可以收集O2、NO等气体,但不能收集NO2气体 | |
| C. | 利用I、Ⅲ装置可以比较H2S04、H2CO3和H2SiO3的酸性强弱 | |
| D. | 利用I、Ⅲ装置既能验证氧化性:Ca(ClO)2>Cl2>Br2,又能保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ | |
| B. | 溶液N为深蓝色,说明溶液N中含大量Cu2+ | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该实验的整个过程共涉及6个化学反应 | |
| B. | 该实验的整个过程只涉及1个氧化还原反应 | |
| C. | 混合物中一定有Al、(NH4)2SO4、MgCl2,一定没有AlCl3、FeCl3 | |
| D. | 混合物中一定有Al、(NH4)2SO4、MgCl2、AlCl3,一定没有FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用微生物电池处理含乙酸钠和对氯酚
利用微生物电池处理含乙酸钠和对氯酚 的废水,工作原理如图所示.下列说法错误的是( )
的废水,工作原理如图所示.下列说法错误的是( )| A. | 电极b是正极 | B. | 质子从b极移向a极 | ||
| C. | 处理后的废水pH降低 | D. | a极的电极反应式: +2e-+H+═ +2e-+H+═ +Cl- +Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
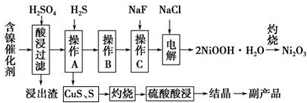 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物对应水化物是强碱 | |
| B. | 原子半径:Y<Z<W | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 原子最外层电子数:W>Z>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com