
【题目】短周期主族元素X、Y、Z、W在周期表中的相对位置如图所示,其中X、Y、W的最外层电子数之和为15,Z和X的最外层电子数相差2,下列说法正确的是
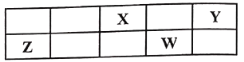
A.原子半径:r(Z)>r(W)>r(Y)>r(X)B.X的氢化物的沸点一定比Y的氢化物的沸点低
C.一定条件下,Z可以置换出XD.X、Y元素的单质均只有2种
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.用铝冶炼铁:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
B.常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O ![]() NH
NH![]() +OH-
+OH-
C.“NO2球”浸泡在热水中,颜色变深:2NO2(g)(红棕色)![]() N2O4(g)(无色)
N2O4(g)(无色) ![]()
D.用酸化的H2O2溶液从灰化的海带中提碘:H2O2+2H++2I-=I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。
(1)若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是___,产生该气体的原因是___(用离子方程式表示)。
(2)微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是___,产生该气体的原因是___。
(3)总反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,设计并实施了以下实验。
(1)实验1:使用下图装置通过干燥管的增重测量CO2的质量。
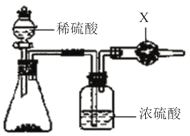
①盛放稀硫酸的仪器名称为________。
②试剂X为________。
③某同学认为装置中干燥管的增重并不能准确表示混合物与稀硫酸反应产生的CO2的质量,其理由是________。
(2)实验2:取a g混合物样品加热、冷却、称重,重复以上操作至固体质量不再变化,测得固体质量变为b g。
①写出加热过程中发生反应的化学方程式________。
②混合物中Na2CO3质量分数为(用a、b表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝苯地平是抗心绞痛药,也可用于降血压,其合成路线如下。
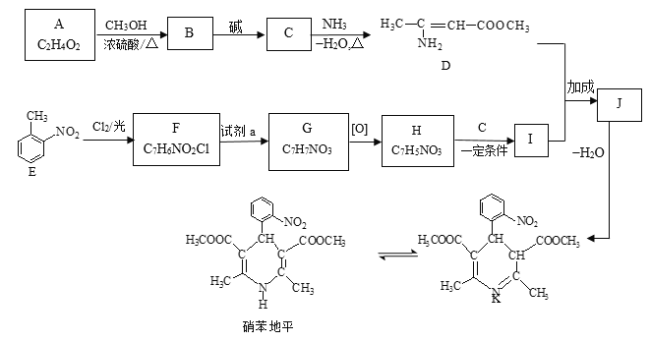
已知: Ⅰ. RCOOR1+![]()
![]()
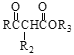 +R1OH
+R1OH
Ⅱ. R1CHO+![]()
![]()
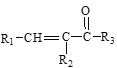
Ⅲ.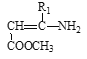 +
+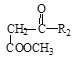
![]()
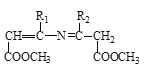
![]()
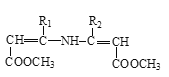
请回答下列问题:
(1)A属于羧酸,写出A的电离方程式________。
(2)A→B的反应类型为________。
(3)D的官能团名称为________。
(4)写出B→C的方程式________。
(5)F→G所需的试剂a是________。
(6)聚合物L的单体是E的同分异构体,其单体结构同时满足以下条件,写出L的结构简式:________。
a. 具有两性 b. 苯环上的一氯代物共有两种
(7)写出结构简式:I________ 、J________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见金属,F是一种红褐色沉淀。根据图中转化关系,回答下列问题。

(1)写出F、G的化学式:F.________;G._______。
(2)检验D中阳离子的方法为_____________________________________________________
(3)保存C溶液时要加固体A的原因是_____________________________________________
(4)写出下列转化的离子方程式:
①B→C:______________________________________________________________________
②C→D:______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol L -1形成M(OH) n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
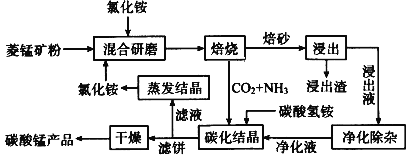
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_____________________________。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为__________③加入NH4F将___________离子(填离子符号)沉淀除去。
(3)碳化结晶时,反应的离子方程式为_____________________________________。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是________________。流程中能循环利用的物质除了氯化铵之外还有____________。
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_______(填“偏高”“ 偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3
Na2CO3
B.Al(s)![]() Al2O3(s)
Al2O3(s)![]() Al(OH)3
Al(OH)3
C.AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D.MgCO3(s)![]() MgCl2(aq)
MgCl2(aq)![]() Mg(s)
Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制药有限公司生产有多种型号的钙尔奇D片剂,为测定某型号片剂中碳酸钙含量,进行如下实验:取10片该片剂碾碎后放入足量的盐酸中充分反应(假设盐酸只与碳酸钙反应)后过滤,取滤液加(NH4)2C2O4使Ca2+生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中并稀释成1L溶液,取20.00mL,然后用0.0500mol·L-1KMnO4溶液滴定,反应中用去12.00mLKMnO4溶液,发生反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
请回答:
(1)该型号片剂中每片含碳酸钙的质量为_____克
(2)该公司一种“钙尔奇D600片剂”(其主要成分与题中某型号的片剂相同,仅仅是碳酸钙的含量不同)的部分文字说明如下:“本品每片含主要成分碳酸钙1.5g(相当于钙元素600mg),成人每天服用1片”。则某型号的片剂应称为“钙尔奇D_____(填数字)片剂。”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com