
| A、1.6molSO2+0.3molO2+0.4molSO3 |
| B、4.0molSO2+1.0molO2 |
| C、2.0molSO2+1.0molO2+2.0molSO3 |
| D、3.0molSO2+1.0molO2+1.0molSO3 |
| 1 |
| 2 |
| 1 |
| 2 |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
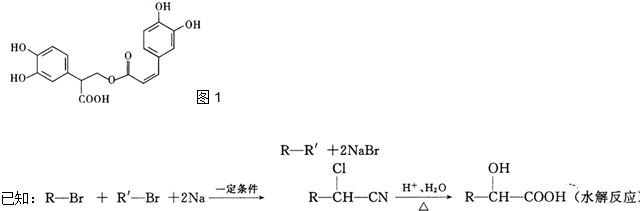
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.其核磁共振氢谱与红外光谱如图,核磁共振氢谱面积之比为3:2:2:1.
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.其核磁共振氢谱与红外光谱如图,核磁共振氢谱面积之比为3:2:2:1.
| 反应条件 |
| 反应物 |
| 反应条件 |
| 反应物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率为v(PCl3)=0.0032 mol?L-1?s-1 |
| B、T℃时,该反应的平衡常数为0.025 |
| C、保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol?L-1,则反应的△H<0 |
| D、相同温度下,向容器中再充入1.0 mol PCl5,达到平衡时,PCl5的转化率大于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A.吸收NH3,并防止倒吸用 | B.除去自来水中的Fe3+获得纯净水 | C.从KI和I2的固体混合物中回收I2 | D.苯提取溴水中的Br2 |
 | 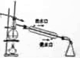 |  | 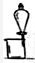 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ca2+、Na+、CO32- |
| B、Na+、Mg2+、OH-、Cl- |
| C、Fe2+、Mg2+、Cl-、H+ |
| D、Ba2+、Cl-、OH-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com