
| 编号 | 实验内容 | 实验目的 |
| A | 将CO2(含HC1杂质)通入饱和NaHCO3溶液中 | 除去HC1 |
| B | 向做完银镜反应后的试管中加入稀氨水 | 除去试管内残留物 |
| C | 向做完淀粉水解后的溶液中直接加入新制的Cu(OH)2,并加热 | 检验淀粉是否水解 |
| D | 将少量FeC12试样加水溶解,加稀硝酸酸化,再滴加KSCN溶液 | 检验FeCl2是否变质 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
| B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

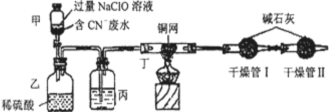
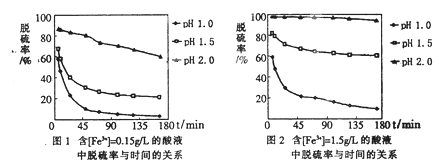
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
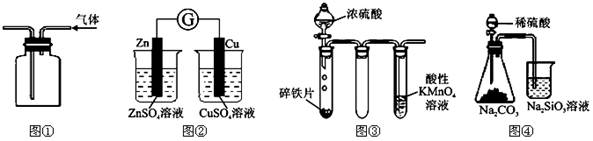
| A.用图①所示实验装置排空气法收集H2气体 |
| B.图②装置可以用来验证化学能转化为电能 |
| C.图③铁片最终完全溶解,且高锰酸钾溶液褪色 |
| D.图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用无水乙醇提取碘水中的碘单质 |
| B.加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42- |
| C.可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液 |
| D.玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
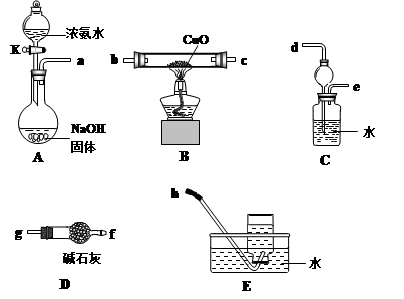
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
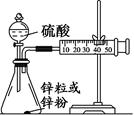
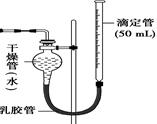
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com