
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | ||
| B、铁片镀锌时,铁片与外电源的正极相连 | ||
| C、NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | ||
D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | A | B | C | D |
| 实验 方案 |
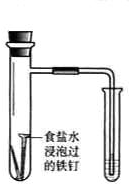 食盐水 |
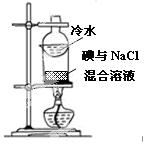 |
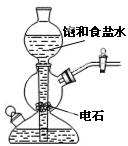 |
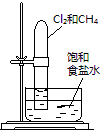 置于光亮处 |
| 实验 目的 |
验证铁钉发生析氢腐蚀 | 从碘与NaCl混合溶液中分离出碘 | 实验室制备乙炔 | 验证甲烷与氯气发生化学反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂为CuI,氧化产物为Cu |
| B、产物Cu2HgI4中,Cu元素的化合价为+2 |
| C、当有2mol CuI参与反应时,转移电子为1mol |
| D、由Cu2+与I直接反应制得CuI的离子方程式为Cu2++I-=CuI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素W与元素X形成的含有共价键的化合物只有一种 |
| B、元素X的单质与元素Y的单质反应时,反应条件不同,产物也不同 |
| C、元素Y与元素W可以原子个数比为1:1的化合物甲,且甲与水反应有气体产生 |
| D、元素Z的单质与元素W.Y的单质都能反应,且反应中Z的单质都做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 |
| B、若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性 |
| C、若M属于离子化合物,则该化合物中只存在离子键 |
| D、若M属于共价化台物,则该分子中原子个数比可能为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
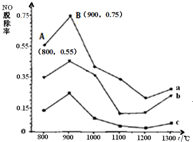 一定条件下,尿素[CO(NH2)2]与NO反应生成N2和另外2种对环境无污染的氧化物.如图是CO(NH2)2与某种烟气中NO的物质的量之比分别为1:2、2:1、3:1时,NO脱除率随温度(t)变化的图象.下列说法错误的是( )
一定条件下,尿素[CO(NH2)2]与NO反应生成N2和另外2种对环境无污染的氧化物.如图是CO(NH2)2与某种烟气中NO的物质的量之比分别为1:2、2:1、3:1时,NO脱除率随温度(t)变化的图象.下列说法错误的是( )| A、尿素脱除NO的反应为:2CO(NH2)2+6NO═2CO2+4H2O+5N2 |
| B、图中a,对应CO(NH2)2与NO的物质的量之比为1:2 |
| C、在900℃左右,NO的脱除率最佳 |
| D、NO的起始浓度为6×10-4mg/m3,图中a从A点到B点经过0.8s,这段时间内NO的脱除平均速率为1.5×10-4mg/(m3?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:| A、该温度下此反应平衡常数为3.2 | ||
| B、A的初始物质的量为4 mol | ||
| C、0-15min内,气体密度不变 | ||
D、要使
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com