
| A. | 碳酸钠溶液 | B. | 氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 溴水 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 实验室用50mL 0.50 mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50 mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣实验小组用流水抽气管对教材中氢气在氯气中燃烧的实验进行了改进,可有效地防治Cl2、HCl对环境的污染,其实验装置如图所示:
某校化学兴趣实验小组用流水抽气管对教材中氢气在氯气中燃烧的实验进行了改进,可有效地防治Cl2、HCl对环境的污染,其实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释或解决方法 |
| A | 大量的燃煤、燃油是形成雾霾的主要原因, | 发展核能等清洁能源,减少化石燃料的使用 |
| B | “地沟油”是被氧化、分解的油脂,禁止食用 | 采用化学技术处理后代替汽油作燃料 |
| C | 氢氧化钠与氢氟酸都能与硅、二氧化硅反应 | 硅、二氧化硅都具有两性 |
| D | 漂白粉在空气中久置变质是 | 漂白粉中的有效成分与空气中的CO2反应生成CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
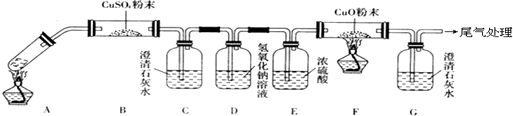
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (苯胺,易被氧化)
(苯胺,易被氧化) ,其核磁共振氢谱图有4个吸收峰;
,其核磁共振氢谱图有4个吸收峰; ;
; ;
; 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种; 的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$
的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com