
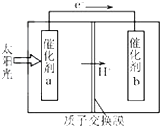
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A、催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| B、催化剂a表面发生氧化反应,有O2产生 |
| C、该过程是将太阳能转化为化学能的过程 |
| D、催化剂b表面的反应是CO2+2H++2e-═HCOOH |


科目:高中化学 来源: 题型:
| A、Y、Z、X、W的原子序数依次减小 |
| B、X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C、由W、X、Y、Z四种元素组成的常见化合物可能显强酸性 |
| D、W与X可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
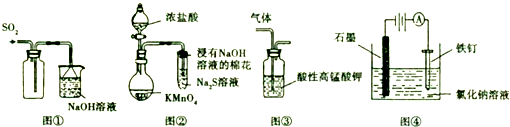
| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
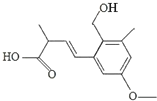 某有机物的结构简式如图,下列叙述正确的是( )
某有机物的结构简式如图,下列叙述正确的是( )| A、该有机物的分子式为C14H20O4 |
| B、该有机物能发生取代、加成和聚合反应 |
| C、1mol该有机物最多能与3mol NaOH反应 |
| D、该有机物分子中所有碳原子一定共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、△H1>△H2;△H3>△H4 |
| B、△H1>△H2;△H3<△H4 |
| C、△H1=△H2;△H3<△H4 |
| D、△H1<△H2;△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量SO2气体通入NaClO溶液中SO2+2ClO-+H2O═SO32-+2HClO |
| B、苯酚钠溶液中通入少量的二氧化碳气体C6H5O-+CO2+H2O═C6H5OH+HCO3- |
| C、足量的溴化亚铁溶液和少量的氯气反应2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向氯化铝溶液中加入过量的氨水Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
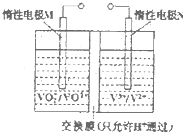 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.查看答案和解析>>
科目:高中化学 来源: 题型:
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.| [NH3?H2O] | ||
[N
|
| 5.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、有机物X与Y互为同系物 |
| B、有机物Y与阿维A酯均能与NaOH溶液反应 |
| C、一定条件下1mol阿维A酯能与4mol H2发生加成反应 |
| D、X中有6种化学环境不同的氢原子,Y中有1个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com