
| A. | CO2→CO | B. | ZnCl2→Zn | C. | KI→I2 | D. | SO3→H2SO4 |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:实验题
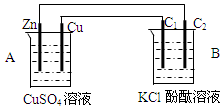 按图装置进行实验,并回答下列问题
按图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
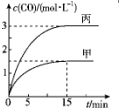 一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、 1mol H2O(g) | 1mol CO、 1mol H2 | 4mol C、 2mol H2O(g) |
| A. | 丙容器的容积V<0.5L | |
| B. | 甲容器中,反应在前15 min内的平均反应速率v(H2)=0.15 mol•L-1•min-1 | |
| C. | 当温度为T1℃时,反应的平衡常数K=2.25 | |
| D. | 乙容器中,若平衡时n(H2O)=0.3 mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1molCH3+所含的电子数为8NA | |
| B. | T℃时,1L pH=6的纯水中含有1×10-6NA个OH- | |
| C. | 23g NO2和23g N2O4的混合气体所含原子数为3NA | |
| D. | 10g 46%的乙醇的水溶液中所含H原子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 | |
| B. | 白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应采取深度填埋法 | |
| D. | 测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com