
恒容容器中,2SO2(g) + O2(g) 2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是
2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是
A.2体积SO2和足量O2反应,一定不能生成2体积SO3
B.其他条件不变,增大压强,正反应速率增大逆反应速率也增大
C.加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍
D.平衡后再加入1molSO3,SO2的转化率增大
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
某课外活动小组的同学从某地颗粒采集器中获得雾霾颗粒样品,然后用蒸馏水浸取。在探究雾霾颗粒可溶性成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.向浸取液中滴入AgNO3溶液有白色沉淀产生,说明雾霾中一定含有Cl-
B.向浸取液中滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42-
C.向浸取液中加入Cu和浓H2SO4,试管口有红棕色气体产生,说明雾霾中可能含有NO3-[源
D.向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有NH4+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:填空题
(每空3分,共6分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧的热化学方程式:______________。
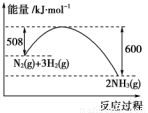
(2)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
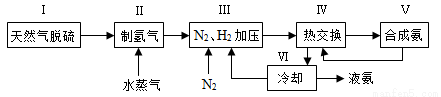
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:____________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
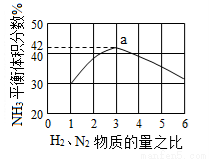
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
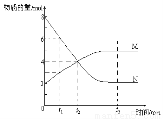
A.反应的化学方程式为: N == 2M
B.t2时,反应物和生成物的浓度相等,达到平衡
C.当M、N都是气体时增大压强,N物质的量减少
D.升高温度,平衡常数K增大,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
对于在密闭容器中、一定条件下进行的可逆反应N2(g)+3H2(g) 2NH3(g),能说明反应已达到平衡状态的是
2NH3(g),能说明反应已达到平衡状态的是
A.各物质体积分数相等 B.c(NH3)保持不变
C.各物质浓度相等 D.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验过程中pH变化如图所示,下列有关叙述正确的是
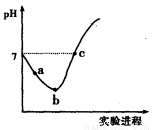
A.实验进程中可用pH试纸测定溶液的pH
B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D.由a点到b点的过程中,溶液中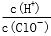 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
 .
.| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol•L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1 NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,向二者的饱和溶液中分别加水,平衡均向沉淀溶解方向移动,c(Mg2+)均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com