
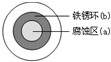
 铁及其化合物在国民经济的发展中起着重要作用.
铁及其化合物在国民经济的发展中起着重要作用.分析 (1)根据4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ•mol-1 ①
C(石墨)+1/2O2(g)=CO(g)△H=-110.5kJ•mol-1 ②
将方程式②×3-$\frac{①}{2}$进行计算;
(2)铁在中性条件下发生吸氧腐蚀,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;为减缓钢铁的腐蚀,可与锌块相连,该方法称为牺牲阳极的阴极保护法;
(3)铁离子具有氧化性,铁能和铁离子发生氧化还原反应;
解答 解:(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ•mol-1 ①
C(石墨)+1/2O2(g)=CO(g)△H=-110.5kJ•mol-1 ②
将方程式②×3-$\frac{①}{2}$得Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=(-110.5kJ•mol-1)×3-(-1641.0kJ•mol-1)×$\frac{1}{2}$=+489.0kJ/mol,
故答案为:+489.0;
(2)铁在中性条件下发生吸氧腐蚀,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应生成氢氧根离子,氢氧根离子和亚铁离子反应生成氢氧化亚铁,氢氧化亚铁不稳定被氧化生成氢氧化铁,所以液滴中心是负极,负极上电极反应式为:Fe-2e-=Fe2+,为减缓钢铁的腐蚀,可与锌块相连,该方法称为牺牲阳极的阴极保护法;故答案为:负极;Fe-2e-=Fe2+;牺牲阳极的阴极保护法;
(3)铁和铁离子发生氧化还原反应生成亚铁离子,离子反应方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查较综合,涉及盖斯定律的应用,铁的吸氧腐蚀、氧化还原反应等知识点,难度不大,掌握基础是关键.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mL pH=2的醋酸溶液加水稀释到10mL,pH变为3 | |
| B. | 常温下,Na2CO3溶液中加水稀释时,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| C. | 向氯水中加入少量NaOH溶液,一定有c(Na+)=c(Cl-)+c(ClO-) | |
| D. | NH4Cl溶液稀释过程中.c(NH4+)与c(NH3•H2O)之和始终保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ | |
| B. | 向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ | |
| C. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3˙H2O═AlO2-+4NH4++2H2O | |
| D. | MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-═Mn2++2Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
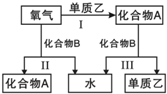 A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题: ;其水溶液呈碱性的原因是NH3+H20
;其水溶液呈碱性的原因是NH3+H20 NH4++OH-(用离子方程式表示).
NH4++OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 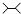 的名称为2,3-二甲基丁烷 的名称为2,3-二甲基丁烷 | |
| B. | 等质量的甲醛、乙酸、葡萄糖完全燃烧耗氧量相等 | |
| C. | 在一定条件下,使煤和氢气作用,可以得到液体燃料 | |
| D. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙原子的最外层有5个电子,其氢化物含有极性键 | |
| B. | 四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强 | |
| C. | 丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物完全反应形成的盐的溶液显酸性 | |
| D. | 乙、丙两元素形成的氢化物稳定性丙的强于乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 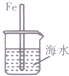 图中,插人海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 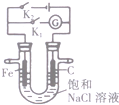 图中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 | |
| C. | 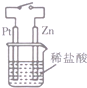 图中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 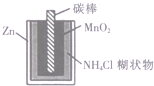 图中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com