
(13分)六配位(八面体)单核配合物MA2(NO2)2呈电中性;组成分析结果:M 31.68%,N 31.04%,C 17.74%;配体A不含氧:配体(NO2)x的氮氧键不等长。
1.该配合物中心原子M是什么元素?氧化态多大?给出推理过程。
2.画出该配合物的结构示意图,给出推理过程。
3.指出配体(NO2)x在“自由”状态下的几何构型和氮原子的杂化轨道。
4.除本例外,上述无机配体还可能以什么方式和中心原子配位?用图形画出三种。
1.nMnN=21.68/MM31.04/14=1(2y+2) MA=19.56×(y+1) y=2(设y为其他自然数均不合题意),得MM=  58.7 (g/mol) 查周期表,M=Ni 由配体(NO2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O,故配体为NO2-,因此,Ni的氧化数为+2。(4分) 注:推理过程合理都给分,不合理,即使结果正确也扣2分。
58.7 (g/mol) 查周期表,M=Ni 由配体(NO2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O,故配体为NO2-,因此,Ni的氧化数为+2。(4分) 注:推理过程合理都给分,不合理,即使结果正确也扣2分。
2.设配合物中碳原子数为nC,则:nCnN=17.74/1231.04/14=0.667 已知nN=2×2+2=6, 所以,nC=0.677×6=4 求出摩尔质量,由于剩余量过小,只能设A是氮氢化合物,由此得氢数,可推得配体A为H2NCH2CH2NH2,配合物的结构示意图为:(4分) 注:合理推理过程2分,结构图2分
3.(根据VSEPR理论,可预言)NO2-为角型,夹角略小于120°,N取sp2杂化轨道。(2分)w.w.w.k.s.5.u.c.o.m 4. 
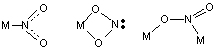 (3分)
(3分)
注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也得分,如氧桥结构、NO2-桥结构等


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com