
NA表示阿伏加德罗常数的值,下列说法正确的是()
A. 电解硫酸时,阴极产生1molH2时,阳极一定产生0.5molO2
B. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C. 电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝
D. 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子
考点: 化学方程式的有关计算;阿伏加德罗常数.
分析: A.电解硫酸时,若为惰性电极阴极生成氢气,阳极生成氧气,且由转移电子可计算生成气体的物质的量;
B.结合n=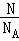 及分子构成计算;
及分子构成计算;
C.发生2Al2O3 4Al+3O2↑,由V=nVm、m=nM计算,但气体状况未知;
4Al+3O2↑,由V=nVm、m=nM计算,但气体状况未知;
D.工业用电解法进行粗铜精炼时,比Cu活泼的金属先失去电子.
解答: 解:A.电极材料未知,阳极不一定生成气体,且转移电子未知,不能计算生成气体的物质的量,故A错误;
B.盛有SO2的密闭容器中含有NA个氧原子,n(O)=1mol=2n(SO2),则SO2的物质的量为0.5mol,故B正确;
C.发生2Al2O3 4Al+3O2↑,则电解1mol熔融的Al2O3,能产生1.5mol氧气、2molAl,即54.0g金属铝,但气体状况未知,不能计算氧气的体积,故C错误;
4Al+3O2↑,则电解1mol熔融的Al2O3,能产生1.5mol氧气、2molAl,即54.0g金属铝,但气体状况未知,不能计算氧气的体积,故C错误;
D.工业用电解法进行粗铜精炼时,比Cu活泼的金属先失去电子,则每转移1mol电子,阳极上溶解少于0.5NA个铜原子,阴极上就生成0.5NA个铜原子,故D错误;
故选B.
点评: 本题考查化学反应方程式的计算,为高频考点,把握电解原理、电解反应及物质的量的计算为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 0.012kg 12C含有的12C是NA个 |
|
| B. | NA个水分子的质量是18g/mol |
|
| C. | 1mol O2中含有的氧气分子数为NA个 |
|
| D. | 含有NA个氧原子的H2SO4的物质的量是0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1molCH3+(碳正离子)含有9 NA个电子 |
|
| B. | 2.5molHe 中含有10 NA个质子 |
|
| C. | 6.02×1022 个H2SO4分子在溶液中可电离出2NA个H+ |
|
| D. | 1molFe与盐酸完全反应可失去电子的物质的量为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
Zn(s)+O2(g)═ZnO(s)△H=﹣Q1 kJ/mol
Hg(l)+O2(g)═HgO(s)△H=﹣Q2kJ/mol
Zn(s)+HgO(s)═Hg(l)+ZnO(s)△H=﹣Q3kJ/mol
Q3值为()
A. Q2﹣Q1 B. Q1+Q2 C. Q1﹣Q2 D. ﹣Q1﹣Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,下列研究目的和示意图相符的是()
A B C D
研究目的 压强对反应的影响
(p2>p1) 温度对反应的影响 平衡体系增加O2的浓度对反应的影响 体积恒定的密闭容器中催化剂对反应的影响
图示 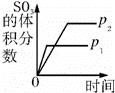
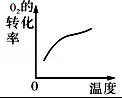

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知N≡N、N﹣H、H﹣H的键能分别为946kJ•mol﹣1、390.8kJ•mol﹣1、436.0kJ•mol﹣1.试根据盖斯定律,写出合成氨反应的热化学方程式 .
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,电极反应式为 ;
与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中,同主族元素从上到下,原子半径逐渐 (填“增大”或“减小”),元素的金属性逐渐 (填“增强”或“减弱”),非金属性逐渐 (填“增强”或“减弱”);同周期从左到右,原子半径逐渐 (填“增大”或“减小”),元素的金属性逐渐 (填“增强”或“减弱”),非金属性逐渐 (填“增强”或“减弱”).
查看答案和解析>>
科目:高中化学 来源: 题型:
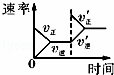
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是()
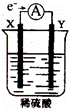
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com