
A.H2O(g)=H2(g)+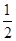 O2(g) ΔH=+242 kJ·mol-1 O2(g) ΔH=+242 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1 |
C.H2(g)+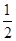 O2(g)=H2O(g) ΔH=+242 kJ·mol-1 O2(g)=H2O(g) ΔH=+242 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1 |
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:不详 题型:单选题
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| B.将煤进行气化处理,提高煤的综合利用效率 |
| C.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 |
| D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )
)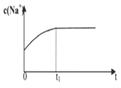 |  |  |  |
| A.溶液中c (Na+)与反应时间t的关系 | B.CH3COO-的水解速率与反应时间t的关系 | C.溶液的PH与反应时间t的关系 | D.KW与反应时间t的关系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)="10.00" mL 时, <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com