
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
分析 A、Fe2+的溶液呈浅绿色;
B、B、依据氢氧化亚铁被氧化为氢氧化铁的过程中的现象分析判断;
C、原溶液中含有铁离子进行实验操作也能出现此现象;
D、氯化铁中的铁离子和硫氰酸根离子反应生成红色溶液.
解答 解:A、Fe2+的溶液呈浅绿色,故当溶液呈浅绿色时,说明含Fe2+,故A错误;
B、滴加NaOH溶液,利用先产生白色沉淀,后变灰绿,最后变为红褐色,说明原溶液含有Fe2+,Fe3+和氢氧化钠溶液反应立即生成氢氧化铁沉淀,所以只能观察到红褐色沉淀,所以该实验能证明某溶液只含有Fe2+而不含Fe3+,故B正确;
C、先滴加氯水,若原溶液含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe2+,故C错误;
D、向溶液中滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再加入氯水,溶液变红,则说明滴入氯水后溶液中含Fe3+,则说明原溶液中含Fe2+,是滴入的氯水将Fe2+氧化为Fe3+,故D正确.
故选:C.
点评 本题考查了三价铁离子、二价铁离子的检验和性质应用,关键是加氧化剂、KSCN溶液的顺序不能颠倒,如果颠倒,无法确定溶原液将中是否含有Fe3+,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NiOOH | B. | Ni(OH)2 | C. | Cd | D. | Cd(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
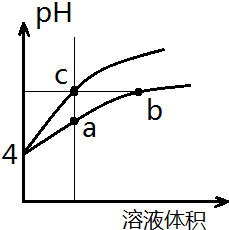 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)=c(OH-)+c(NH3•H2O) | |
| C. | a、b、c三点溶液水的电离程度a>b>c | |
| D. | 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com