
| A. | 气态氢化物的热稳定性:X<W | |
| B. | 最高价氧化物对应水化物的酸性:W<Z | |
| C. | 电负性:Z<W | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z的价电子排布为3s23p3,Z为P元素.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z的价电子排布为3s23p3,Z为P元素.
A.非金属性X(O)>W(S),故氢化物稳定性X>W,故A错误;
B.非金属W(S)>Z(P),故最高价氧化物对应水化物的酸性:硫酸>磷酸,故B错误;
C.同周期自左而右电负性增大,故电负性Z(P)<W(S),故C正确;
D.同周期自左而右,原子半径减小,同主族电子层越多原子半径越大,故原子半径Mg>P>S>O,即rY>rZ>rW>rX,故D正确.
故选:CD.
点评 本题考查结构性质与位置关系应用,侧重对元素周期律的考查,难度不大,推断元素是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水、浓硫酸 | B. | KMnO4酸性溶液、浓硫酸 | ||
| C. | 溴水、浓硫酸 | D. | 浓硫酸、KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电电池可以通过放电、充电实现化学能和电能的相互转化 | |
| B. | 放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应 | |
| C. | 现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理 | |
| D. | 充电电池的化学反应原理是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 1mol A与足量B完全反应共转移了2mol电子 | |
| C. | 丙元素在周期表中的位置为第二周期第ⅣA族 | |
| D. | 甲、乙、丙、丁四种元素可以共同组成多种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
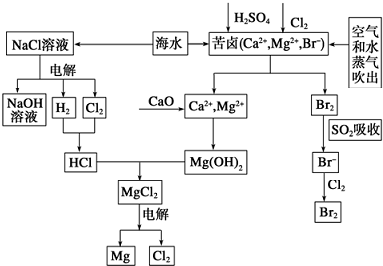
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KMnO4(H+)溶液鉴别甲苯、丙烯、已烷 | |
| B. | 用溴水鉴别苯、丙烯、四氯化碳 | |
| C. | 用水鉴别乙醇、苯、四氯化碳 | |
| D. | 用NaOH溶液鉴别溴乙烷、甲苯、硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 深蓝色的[Cu(NH3)4]SO4溶液中加入乙醇析出晶体 | 乙醇增强了溶剂的极性 |
| B | 用KSCN检验溶液中的Fe3+ | Fe3+遇SCN-生成血红色沉淀 |
| C | CH4熔点低于CO2 | 碳氢键比碳氧键的键长短、键能大 |
| D | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅可用作光导纤维 | |
| B. | 氯气具有氧化性,干燥的氯气可以漂白有色物质 | |
| C. | 氧化铝熔点高、硬度大,常用于耐高温材料 | |
| D. | 二氧化硫能使品红溶液褪色,可以漂白所有有色物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com