
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
分析 将煤块粉碎,增大与空气的接触面积,能煤充分燃烧,提高煤能的利用率,并减少CO的产生,经脱硫处理可减少SO2的产生,避免造成“酸雨”.
解答 解:①将煤块粉碎,增大与空气的接触面积,能煤充分燃烧,提高煤能的利用率,故①正确;
②煤中含有S元素,燃烧时能生成SO2,经脱硫处理可减少SO2的产生,避免造成“酸雨”,故②正确;
③在适当过量的空气中燃烧,生成CO2,减少CO的产生,故③正确;
④无论是否脱硫处理,在适当过量的空气中燃烧,生成CO2的量都不变,不能减少CO2的产生,故④错误.
所以正确的是①②③.
故选D.
点评 本题考查常见生活污染及治理,题目难度不大,注意题中“将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧”等信息.


科目:高中化学 来源: 题型:填空题
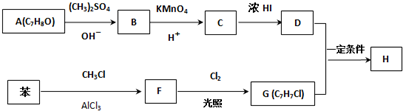
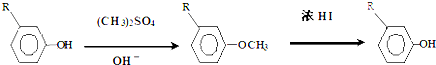
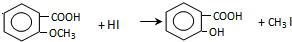 .
.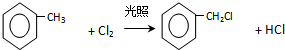 .
.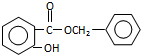 .
.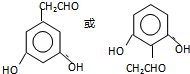 .
.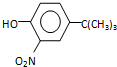
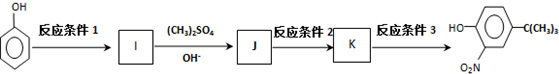
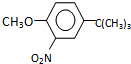 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
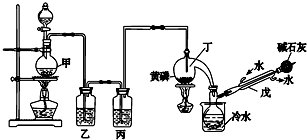
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| B. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+═4Cr3++11H2O+3CH3COO- | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
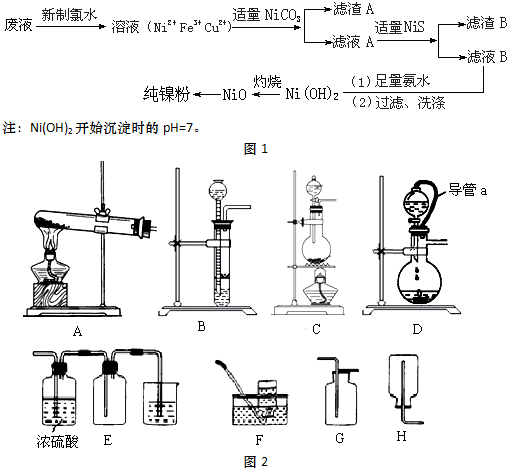
| 难溶电解质 | NiS | CuS | Cu(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp或沉淀完全的pH | 1.1×10-21 | 1.3×10-36 | pH=9 | pH=9.5 | pH=3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 47 | B. | 57 | C. | 61 | D. | 175 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
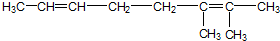 ,与过量的酸性KMnO4溶液作用,得到下列三种化合物:
,与过量的酸性KMnO4溶液作用,得到下列三种化合物: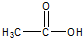 、
、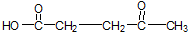 和
和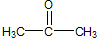 .化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
.化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )| A. | 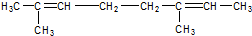 | B. | 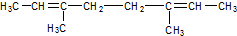 | ||
| C. | 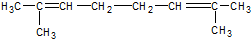 | D. | 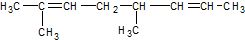 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
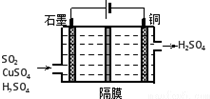 氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com