
A Z |


科目:高中化学 来源: 题型:
| A、34gH2O2中含有的阴离子数为2NA | ||
| B、15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1mol/LNH4Cl溶液中含NH4+数小于NA | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
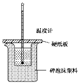 某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )
某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D、酸或碱的物质的量越大,所测中和热的数值越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 1.44 | 9.6 | 9.6 |
| 催化剂 |
| n(H2) |
| n(CO2) |
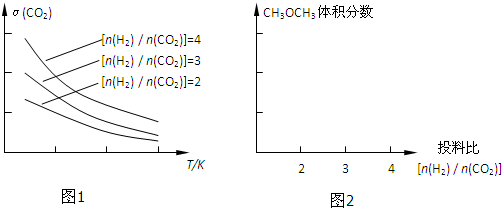
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验过程和现象 | 对应结论 | |
| 步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 |  | |
| 步 骤 2 | 第①份 试液 | 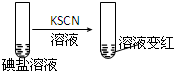 | 碘盐中肯定含 |
| 第②份 试液 | 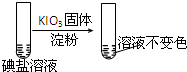 |  | |
| 第③份 试液 |  | X为 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:| O2/Cu |
| △ |
| C |
| 一定条件 |
| (1)[Ag(NH3)2]OH,△ |
| (2)H+ |
| F |
| 浓H2SO4△ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量的H2S气体通入硫酸铜溶液中:H2S+Cu2+=CuS↓+2H+ |
| B、将NO2气体通入水中:2NO2+H2O=NO3-+NO↑+2H+ |
| C、ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中:ICl+2OH-=I-+ClO-+H2O |
| D、往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2:2Br-+Cl2=Br2+2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com