
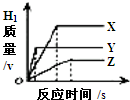
 将相同体积、相同溶质质量分教的稀盐酸,分别加入到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中(金属完全反应〕,生成H2的质量与反应时间的关系如图所示.下列说法中正确的是( )
将相同体积、相同溶质质量分教的稀盐酸,分别加入到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中(金属完全反应〕,生成H2的质量与反应时间的关系如图所示.下列说法中正确的是( )| A、三种金属的活动性顺序为Y>X>Z |
| B、产生氢气的速率顺序为X>Y>Z |
| C、消耗稀盐酸的质量顺序为Z>Y>X |
| D、相对原子质量由大到小的顺序为X>Y>Z |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、粘胶纤维、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| B、N7H9禽流感病毒并不可怕,人只要喝一定量盐水,就能杀死该病毒 |
| C、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小、有磁性,它与金刚石都属于碳的同素异形体 |
| D、分子间作用力比化学键弱得多,它对物质的熔点、沸点有较大影响,但对溶解度无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NaHCO3溶液中:c(HCO3-)+c(CO32-)+c(OH-)>c(Na+)+c(H+)+c(H2CO3) |
| B、常温下,5mL 0.02mol/L HCl溶液与5mL 0.02mol/L Ba(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液pH=12 |
| C、相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸,三种溶液中由水电离产生的c(H+):①>②>③ |
| D、常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内颜色保持不变 |
| B、v逆(NO)═2v正(O2) |
| C、单位时间内生成a mol的O2,同时生成2a mol NO2 |
| D、容器内密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成纤维、塑料、合成橡胶都是高分子化合物 |
| B、煤的气化和煤的液化都可以使煤变为清洁能源,煤的气化和煤的液化都属于物理变化 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、页岩气是从页岩层中开采出来的天然气.由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将苯滴入溴水中,振荡后水层接近无色 |
| B、乙烯使酸性KMnO4溶液褪色 |
| C、甲烷与氯气混合,光照后黄绿色变浅 |
| D、乙烯使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①⑤ | D、③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com