
 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
| 5.56×1023 |
| a3NA |
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
| 5.56×1023 |
| a3NA |
| 5.56×1023 |
| a3NA |


科目:高中化学 来源: 题型:
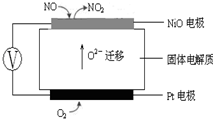 (1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1| 催化剂 |
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
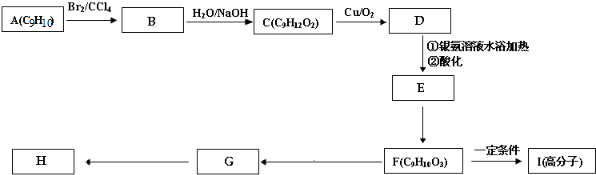
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度 |
| B、通入少量HCl气体 |
| C、加入少量Fe粉 |
| D、加入适量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在潮湿疏松的土壤中 |
| B、在含铁元素较多的酸性土壤中 |
| C、在干燥致密不透气的土壤中 |
| D、在含碳较多的潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、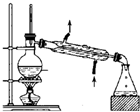 装置常用于分离互不相溶的液体混合物 |
B、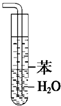 装置可用于吸收氨气,且能够防止倒吸 |
C、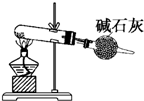 以NH4Cl和熟石灰为原料,装置可用于制备少量NH3 |
D、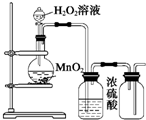 装置可用于制取并收集干燥的O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com