
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2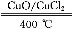 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
有机物X、Y、M(M为乙酸)的转化关系为: ,下列说法错误的是
,下列说法错误的是
A.X可用新制的氢氧化铜检验
B.反应X→Y中,1molX可生成3molY
C.由Y生成乙酸乙酯的反应属于取代反应
D.可用碘的四氯化碳溶液检验淀粉是否水解完全
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e- Cu
Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:填空题
)以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去Fe3+所发生的总反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:选择题
常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HC)>c(C)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(N)>c(OH-)=c(H+)
D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第一章检测试卷(解析版) 题型:选择题
已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g) 8CO2(g)+9H2O ΔH=-48.40 kJ·mol-1
8CO2(g)+9H2O ΔH=-48.40 kJ·mol-1
B.C8H18(l)+O2(g) 8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C.C8H18(l)+O2(g) 8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D.C8H18(l)+O2(g) 8CO2(g)+9H2O(l) ΔH=+48.40 kJ·mol-1
8CO2(g)+9H2O(l) ΔH=+48.40 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3电解原理的应用试卷(解析版) 题型:选择题
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为:2Cu+H2O Cu2O+H2↑。下列说法正确的是( )
Cu2O+H2↑。下列说法正确的是( )
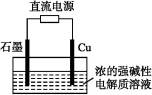
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2一次电池二次电池试卷(解析版) 题型:填空题
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:
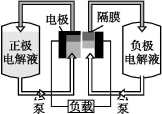
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是 ,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是 。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、V)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O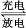 +V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
+V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是 。
a.V、VO2+混合液
b.V3+、V2+混合液
c.V溶液
d.VO2+溶液
e.V3+溶液
f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.3盐类水解的应用试卷(解析版) 题型:选择题
向浓度为0.1 mol·L-1的K2CO3溶液中分别加入下列物质,能使c(C)增大的是( )
A.H2OB.CO2 C.KHSO4固体 D.KOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com