
分析 (1)一元弱酸HA 电离平衡常数K=$\frac{c({A}^{-})c({H}^{+})}{c(HA)}$;
(2)AlCl3属于强酸弱碱盐,在溶液中存在水解平衡,蒸发溶液水解生成的氯化氢挥发促进平衡正向进行,得到水解产物氢氧化铝,灼烧得到氧化铝;
(3)在NaHCO3溶液中存在碳酸氢根离子的水解平衡、电离平衡和水的电离平衡;
(4)氢离子抑制铵根离子水解;
(5)往0.1mol•L-1MgCl2溶液滴加烧碱溶液至pH=11,结合溶度积常数计算;
解答 解:(1)实验测得0.1mol•L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$mol•L-1=10-7mol•L-1,
故答案为:10-7mol•L-1;
(2)氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)3不稳定,灼烧时分解生成Al2O3,
故答案为:Al2O3 ;
(3)在NaHCO3溶液存在碳酸氢根离子的水解平衡为:HCO3-+H2O?H2CO3+OH-,电离平衡:HCO3-?H++CO32-,水的电离平衡H2O?H++OH-,碳酸氢根离子水解程度大于电离程度导致溶液显碱性,
故答案为:HCO3-?H++CO32-; HCO3-+H2O?H2CO3+OH-;
(4)NH4HSO4中氢离子抑制铵根离子水解,NH4Cl是强酸弱碱盐,铵根离子能水解但较弱,c(NH4+):前者>后者,
故答案为:>;
(5)往0.1mol•L-1MgCl2溶液滴加烧碱溶液至pH=11,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,已知298K时,Mg(OH)2的溶度积常数Ksp=c(Mg2+)c2(OH-)=5.6×10-12,此时c(Mg2+)=$\frac{5.6×1{0}^{-12}}{(1{0}^{-3})^{2}}$=5.6×10-6,
故答案为:5.6×10-6;
点评 本题考查了弱电解质电离平衡、盐类水解平衡、沉淀溶解平衡等知识点,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为1.204×1023个 | |
| C. | 可生成O2的体积为0.224 L | |
| D. | 生成H2的量理论上等于0.02mol Zn与足量盐酸反应产生H2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+HSO3- | |
| B. | 硅酸钠溶液中通人足量二氧化碳:SiO32-+2CO2+3H2O═H4SiO4↓+2HCO3- | |
| C. | 向硫酸氢钾溶液中加入Ba(OH)2溶液至刚好沉淀完全:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ | |
| D. | 小苏打溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1mol/L的溶液中:K+、Mg2+、SCN-、SO42- | |
| B. | c(H+)=1mol/L的溶液中:Cu2+、Na+、ClO-、S2- | |
| C. | 能使酚酞变红的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | pH=2的溶液中:Na+、Ag+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24LO2、O3的混合气体含有NA个分子 | |
| B. | 28 g CO和N2混合气体含有NA个分子 | |
| C. | 标准状况下,4.48 L水含有的分子数等于0.2NA | |
| D. | 标准状况下,CO2与Na2O2反应生成2.24 L O2转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  可用装置鉴别碳酸钠和碳酸氢钠 | |
| B. | 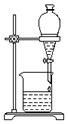 可用装置分离汽油和水的混合物 | |
| C. | 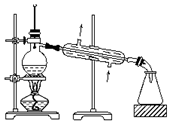 可用装置从海水中蒸馏得到淡水 | |
| D. | 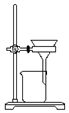 可用装置把胶体粒子从分散系中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
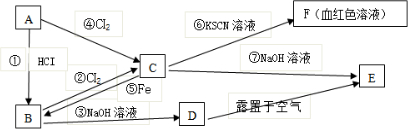
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 实验室中金属钠不慎着火后,立马使用细沙盖灭 | |
| D. | 不慎将浓硫酸溅到皮肤上,应立即用水冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com