
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.反应时释放大量热并快速产生大量气体.已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol.又知:H2O(g )=H2O (l)△H=-44kJ•mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为712kJ.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.反应时释放大量热并快速产生大量气体.已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol.又知:H2O(g )=H2O (l)△H=-44kJ•mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为712kJ.分析 (1)根据题中数据结合热化学方程式的意义书写该反应的热化学方程式;根据盖斯定律及热化学方程式计算出反应的热量;
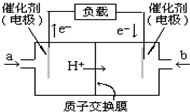
(2)原电池中电子从负极经外电路流向正极,负极反应氧化反应,负极是甲醇失电子发生氧化反应,依据电极反应的产物和环境写出电极反应式,正极是氧气得到电子发生还原反应.
解答 解:(1)在101kPa(25℃时)时,已知1mol液态肼与足量氧气反应,生成氮气和水蒸气,放出624KJ的热量,则该反应的热化学方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;如果生成液态水,1mol肼完全反应放出的热量为:624kJ+44×2kJ=712kJ,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol;712;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知a处电极为负极,甲醇在负极上发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,所以b处通入的物质是空气或氧气,电池的正极反应式为:O2+4H++4e-=2H2O,
故答案为:CH3OH-6e-+H2O=CO2+6H+;空气或氧气.
点评 本题考查了热化学方程式的书写、有关反应热的计算、原电池的原理应用,注意燃料电池的特征是燃料是电子在负极反应,氧气在正极发生还原反应,试题培养了学生的分析、理解能力及灵活应用所学知识的能力,题目难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl电离方程式:KCl=K++Cl- | B. | 光导纤维主要成分的化学式:Si | ||
| C. | 中子数为20的氯原子:1720Cl | D. | S2-的结构示意图: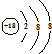 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.75 mol | B. | 1.5 mol | C. | 1.0 mol | D. | 0.67 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其它条件不变,若升高温度,X的体积分数增大,则该反应的正反应△H>0 | |
| B. | 其它条件不变,将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其它条件不变,若增大压强,则物质Y的转化率减小 | |
| D. | 以X浓度变化表示的反应速率为0.001mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
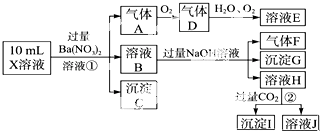
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com