
 2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.物质 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
分析 (1)依据热化学方程式和盖斯定律计算[①+②+③×4]×$\frac{1}{2}$得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式;
(2)①依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断,由正逆反应速率相同衍生的关系,变量不变说明反应达到平衡状态;
②20min-30min反应达到平衡,图表中得到平衡浓度,依据平衡常数的概念计算得到;
③根据Qc与K的大小判断,Qc<K时化学平衡正向移动,Qc>K时化学平衡逆向移动,Qc=K时化学平衡不移动;
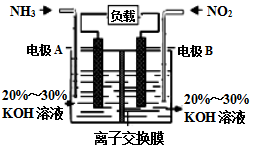
(3)由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应,结合电解质溶液呈碱性解答.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0kJ•mol-l
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160.0kJ•mol-l
③H2O(g)═H2O(l)△H=-44.0kJ•mol-l
依据盖斯定律计算[①+②+③×4]×$\frac{1}{2}$得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955.0 kJ•mol-1,
故答案为:-955.0 kJ•mol-1;
(2)①C(s)+2NO(g)?N2(g)+CO2(g),反应是气体体积不变的反应.
A.活性炭的质量保持不变说明达到平衡状态,故A不选;
B.反应速率之比等于化学方程式系数之比,当v正(N2)=2v逆(NO),不能说明反应达到平衡,当2v正(N2)=v逆(NO)则能说明达平衡,故B可选;
C.反应是气体体积不变的反应,反应过程中压强始终不变,所以容器内压强保持不变不能说明反应达到平衡,故C可选;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变时,说明反应达到平衡,故D不选;
E.混合气体的平均相对分子质量等于气体总质量除以总物质的量,反应中碳是固体,平衡移动,气体质量发生变化,气体物质的量不变,混合气体的平均相对分子质量保持不变时,说明反应达到平衡状态,故E不选;
故答案为:BC;
②20-30min反应达到平衡状态,C(s)+2NO(g)?N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.030mol/L;c(NO)=0.040mol/L,反应的平衡常数为:K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(NO)}$=$\frac{0.030×0.030}{0.04{0}^{2}}$=0.56,
故答案为:0.56;
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则此时Qc=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(NO)}$=$\frac{0.034×2×0.017}{(0.032×2)^{2}}$=0.28<K=0.56,则化学平衡正向移动,
故答案为:正向移动;
(3)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
②由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应.
A.电子从负极流出,正极流入,则电子从左侧电极经过负载后流向右侧电极,故A错误;
B.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,故B正确;
C.根据总反应可知反应生成水,电解质溶液的碱性减弱,pH减小,故C错误;
D.不是标准状况下无法计算NO2的物质的量及转移电子的物质的量,故D错误;
故答案为:B.
点评 本题综合考查了热化学方程式和盖斯定律的计算、化学平衡常数、化学平衡影响因素、平衡标志的分析判断,侧重于学生的分析能力和计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管 | |
| C. | Ni-Zn化合物的纳米颗粒可作 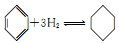 反应的催化剂,提高苯的转化率 反应的催化剂,提高苯的转化率 | |
| D. | 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
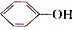 )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子 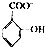 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是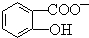 中形成分子内氢键,使其更难电离出H+,故Ka2<Ka.
中形成分子内氢键,使其更难电离出H+,故Ka2<Ka.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子的空间构型为直线形 | |
| B. | CO2分子为含有极性键的极性分子 | |
| C. | BF3分子中的B原子不满足8电子稳定结构 | |
| D. | CH3COOH分子中C原子均为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA | |
| D. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
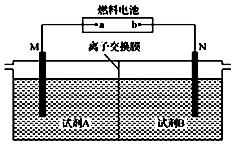 以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )| A. | b电极的反应式为CH3OCH3+3H2O-12e-═2CO2↑+12H+ | |
| B. | 试剂A为饱和食盐水,试刑B为NaOH稀溶液 | |
| C. | 阳极生成1 mol气体时,有1mol离子通过离子交换膜 | |
| D. | 阴极生成1 mol气体时,理论上导线中流过2 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:Na+、K+、MnO4-、SO42- | |
| B. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| C. | 使酚酞变红色的溶液:Na+、Al3+、CO32-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 | |
| B. | 绿色化学要求从源头上消除或减少生产活动对环境的污染 | |
| C. | 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 | |
| D. | 天然气和液化石油气是我国目前推广使用的清洁燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com