
 铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.
铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.- 4 |
| 338g |
| 52g/mol |
| (56-19.5)mol |
| 2 |
| ||
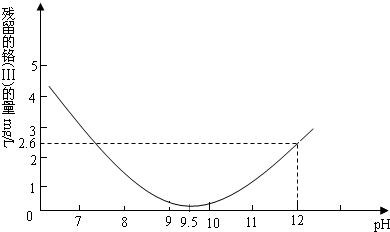
| 0.01mol/L |


科目:高中化学 来源: 题型:
| A、阿伏加德罗常数NA是0.012 kg l2C中所含的原子数 |
| B、2g氢气所含氢原子数目为NA |
| C、标准状况下,11.2 L NH3所含的原子数目为0.5 NA |
| D、含71 g Na2SO4的溶液中所含Na+离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中产生气泡量减少;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5%H2O2溶液和5mL 10%H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
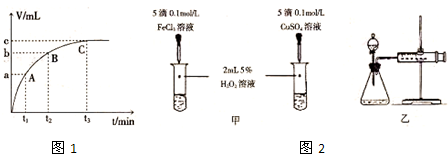
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
)是一种有机化工基础原料,工业上的主要合成途径及有关反应如下: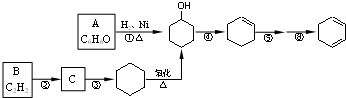
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中所得溶液中c(Cl-)-c(M+)=9.9×10-7mol/L |
| B、①c(H+)-c(MOH)=1×10-8mol/L |
| C、由②中信息知MOH的电离程度<M+的水解程度 |
| D、②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
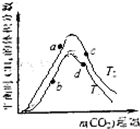 一种将CO2变为燃料或有机化学品的构想分成3个步骤:
一种将CO2变为燃料或有机化学品的构想分成3个步骤:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
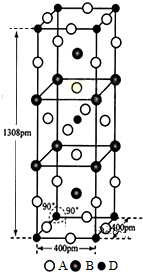 〔化学--选修3:物质结构与性质〕
〔化学--选修3:物质结构与性质〕查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com