
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
分析 Ba2++SO42-═BaSO4↓表示可溶性钡盐或者氢氧化钡与可溶性硫酸盐或者硫酸反应只生成硫酸钡沉淀,据此解答.
解答 解:A.BaCl2溶液与稀硫酸反应,反应实质为钡离子与硫酸根离子生成硫酸钡,离子方程式:Ba2++SO42-═BaSO4↓,故A正确;
B.Ba(OH)2溶液与Na2SO4溶液反应,离子方程式:Ba2++SO42-═BaSO4↓,故B正确;
C.Ba(OH)2溶液与NaHSO4溶液反应,离子方程式:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故C错误;
D.Ba(NO3)2溶液与MgSO4溶液反应,离子方程式:Ba2++SO42-═BaSO4↓,故D正确;
故选:C.
点评 本题考查了离子方程式书写,明确离子方程式书写方法及离子方程式的意义是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
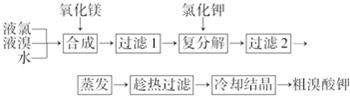
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 代号 | 信息 |
| A | 原子最外层电子数为内层电子数的2倍 |
| C | 形成的一种单质可抵御紫外线对地球生物的伤害 |
| D | 是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色 |
| E | 单质是生活中使用最广泛的金属 |
| F | 形成的一种化合物可用于醛基的检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Li>Cs>Na | B. | 微粒半径:Ca2+>C1->Mg2+ | ||
| C. | 碱性:KOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:Cu2+>Fe3+>K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(溴):加入KI溶液,振荡,分液 | |
| B. | 乙烷(乙烯):通过盛有KMnO4溶液的洗气瓶 | |
| C. | 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液 | |
| D. | 乙烯(SO2):通过盛有溴水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 | |
| B. | Y与Q在常温下不易反应 | |
| C. | 最高价氧化物的水化物的酸性:L>Z | |
| D. | M单质容易形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胆矾 CuSO4•5H2O 盐 蓝色 | |
| B. | 生石灰 CaO 氧化物 白色 | |
| C. | 纯碱 NaOH 碱 白色 | |
| D. | 盐酸 HCl 酸 无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com