

| A. | 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性 | |
| B. | 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出 | |
| C. | 若试剂A选择氯水,则试剂B可选择NaOH标准液 | |
| D. | 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液 |
分析 流程的实验原理:样品中加稀硫酸生成二氧化硫,通氮气将生成的二氧化硫从溶液中全部赶出,得到气体为氮气和二氧化硫的混合气体,可以将之通入双氧水中,二氧化硫被氧化成硫酸,再用氢氧化钠中和得中和液含有硫酸钠,据耗碱量可以计算出生成的硫酸的物质的量,利用硫元素守恒可知二氧化硫的质量,结合样品的质量可求得样品中亚硫酸盐含量.
解答 解:流程的实验原理:样品中加稀硫酸生成二氧化硫,通氮气将生成的二氧化硫从溶液中全部赶出,得到气体为氮气和二氧化硫的混合气体,可以将之通入双氧水中,二氧化硫被氧化成硫酸,再用氢氧化钠中和得中和液含有硫酸钠,据耗碱量可以计算出生成的硫酸的物质的量,利用硫元素守恒可知二氧化硫的质量,结合样品的质量可求得样品中亚硫酸盐含量.
A、亚硫酸根离子易被空气中的氧气氧化为硫酸根,葡萄酒中加亚硫酸盐的主要目的是防止葡萄酒氧化,利用了亚硫酸盐的还原性,故A正确;
B、根据上述分析知道:通氮气是为了将生成的二氧化硫从溶液中全部赶出,故B正确;
C、二氧化硫具有还原性,可以被氯水氧化为硫酸,但是氯水也可以和氢氧化钠之间反应,所以此时不能选择NaOH标准液,故C错误;
D、若试剂A选择碱液,可以和二氧化硫之间反应得到亚硫酸盐或是亚硫酸氢盐,该盐可以被碘单质氧化为硫酸盐,试剂B可选择I2标准液,故D正确.
故选C.
点评 本题目以工艺流程题的方式考查学生元素以及化合物的性质知识,注意原子守恒思想在解题中的应用,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O═2Fe(OH)3 | |
| D. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
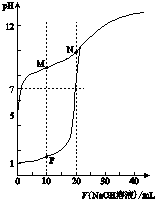 用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
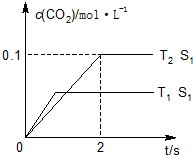 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com