
【题目】对细胞中某些物质的组成进行分析,可以作为鉴定真核生物的不同个体是否为同一物种的辅助手段,一般不采用的物质是
A. 核苷酸 B. DNA C. RNA D. 蛋白质
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3—的方程式: 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
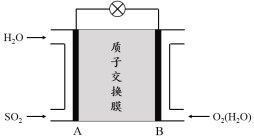
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
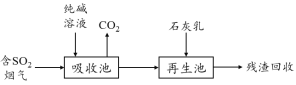
① 用纯碱溶液吸收SO2将其转化为HSO3—,反应的离子方程式是 。
② 若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
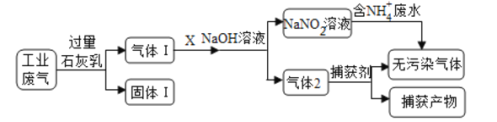
下列说法不正确的是( )
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
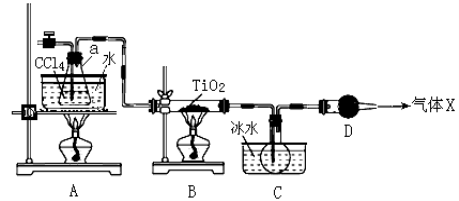
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
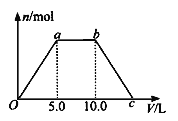
⑤ 若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 含有碳元素的化合物都是有机物
B. 1mol CH4与等物质的量的Cl2在光照条件下生成 1mol CH3C1
C. 完全燃烧只生成CO2和H2O的化合物都是烃
D. 有机物有的不溶于水,有的可溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
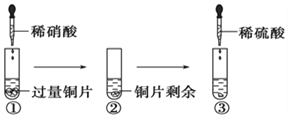
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向CuSO4溶液中投入Na:Cu2++2Na=Cu+2Na+
B.向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓
C.向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
D.向BaCl2溶液中通入SO2气体:SO2+H2O+Ba2+=BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成物总能量高于反应物总能量的是
A.氢氧化钠溶液与稀硫酸混合 B.异丁醇燃烧
C.氢氧化钡晶体与氯化铵晶体混合搅拌 D.氧化钙溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O反应时通常加入过量的Ca(OH)2,其目的是 。
CaO2·8H2O反应时通常加入过量的Ca(OH)2,其目的是 。
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有____________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,等MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2![]() MnO(OH)2
MnO(OH)2 ![]() I2
I2 ![]() S4O62
S4O62
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式 ;
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为 mg·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com