
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
【答案】C
【解析】
反应达到平衡时移走0.5 mol O2和0.5 mol SO2,达到新的平衡状态,该状态可以等效为开始加入时0.5 mol O2和0.5 mol SO2,所到达的平衡状态,与原平衡相比,压强降低,平衡向逆反应移动,反应的转化率降低。
将1 mol SO2和1 mol O2通入体积不变的密闭容器中,反应达到平衡时移走0.5 mol O2和0.5 mol SO2,达到新的平衡状态,该状态可以等效为开始加入时0.5 mol O2和0.5 mol SO2,所到达的平衡状态,与原平衡相比,压强降低,平衡向逆反应移动,反应的转化率降低,若转化率不变时,生成的SO3为0.15 mol,因为转化率降低,故生成的SO3小于0.15 mol,所以C选项是正确的;
综上所述,本题选C。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】普通干电池,是一种广泛使用的可移动化学电源,其结构如图甲所示,电池反应是:![]() 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
实验一、用废锌制取防腐剂皓矾![]() 图乙
图乙![]()
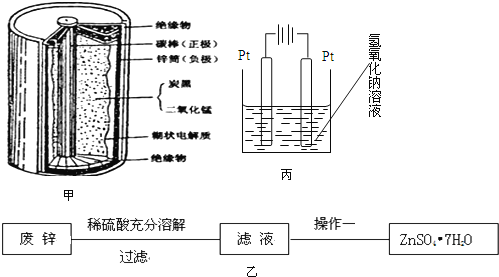
![]() 操作一的名称是:______。
操作一的名称是:______。
![]() 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物![]() 四羟基锌酸钠
四羟基锌酸钠![]() 和
和![]() ,该配合物中心离子是______,配位数是 ______。
,该配合物中心离子是______,配位数是 ______。
实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
![]() 灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物
灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物![]() 和
和![]() 。
。
![]() 写出
写出![]() 与浓盐酸反应的离子方程式: ______ 。
与浓盐酸反应的离子方程式: ______ 。
![]() 取
取![]() 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气![]() ,则混合物中
,则混合物中![]() 和
和![]() 质量之比是: ______ 。
质量之比是: ______ 。
实验三、查询资料得知,还可以通过电解的方式,将![]() 转化为
转化为![]() ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置![]() 图丙
图丙![]() ,将混合物粉末调成糊状,附在其中的 ______ 边电极上
,将混合物粉末调成糊状,附在其中的 ______ 边电极上![]() 填左或者右
填左或者右![]() ,该电极上发生的电极反应式是: ______
,该电极上发生的电极反应式是: ______ ![]() 在电解过程中溶液的pH将 ______填变大、变小、不变
在电解过程中溶液的pH将 ______填变大、变小、不变![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石![]() 碳化硅
碳化硅![]() 晶体硅
晶体硅
C.晶格能由大到小:NaF>NaCl>NaBr>NaI
D.熔点由高到低:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置,A、B和C是中学常见的化合物,回答问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)上述所列元素中,最高价氧化物的水化物的酸性最强的是________(填化学式)。
(2)②元素最高正价与④元素形成的化合物的电子式是__________。
(3)⑤⑨两种元素形成氢化物的水溶液的酸性由弱到强的顺序为________(用化学式表示)。
(4)从④⑥两种元素形成的化合物与④⑧两种元素形成的化合物的混合物中分离提纯④⑧两种元素形成的化合物,可加入上表中________(用元素符号表示)两种元素形成的化合物的水溶液后,再过滤洗涤。
(5)③元素的气态氢化物与其最高价氧化物的水化物反应生成的物质为________(用化学式表示),该物质所含化学键类型有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。合成肉桂酸甲酯的工业流程如下图所示:
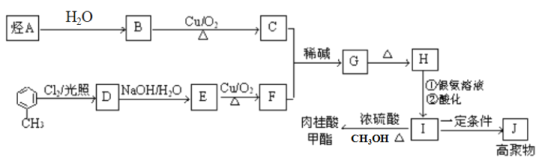
已知:I. 烃A在标准状况下的密度为1.25 g/L。
II.醛与醛能发生反应,原理如下:
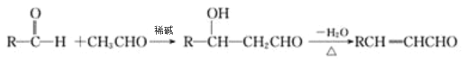
请回答:
(1)化合物H中的官能团为_____________________。
(2)肉桂酸甲酯的结构简式为_________________,J的结构简式为____________。
(3)G→H的反应类型为________。
(4)写出反应B→C的化学方程式___________________________。
(5)符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成
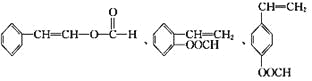 、_________、__________
、_________、__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2 SO2(g)+O2(g)![]() 2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
A. 升高温度,可以加快反应速率
B. 在上述条件下,SO2不能完全转化为SO3
C. 使用催化剂是为了加快反应速率
D. 达到平衡时,SO2的浓度与SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中通入2mol NH3,在一定温度下发生下列反应:2NH3![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内
N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内![]() 的百分含量也为a%的是( )
的百分含量也为a%的是( )
A.3mol H2+2mol N2B.2mol NH3+1mol N2
C.3mol N2+1mol H2D.0.lmol NH3+0.95mol N2+2.85mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为![]() 的密闭容器中充入
的密闭容器中充入![]() 气体和
气体和![]() 气体,在一定条件下发生如下反应:
气体,在一定条件下发生如下反应:![]() ;经
;经![]() 后达到平衡,测得C气体的浓度为
后达到平衡,测得C气体的浓度为![]() 。下列说法中正确的是
。下列说法中正确的是![]()
![]()
①用物质A表示该反应的平均反应速率为![]()
②用物质B表示该反应的平均反应速率为![]()
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为![]()
⑤其他条件不变,向容器中再加入![]() 气体,达到新平衡时,C的体积分数不变
气体,达到新平衡时,C的体积分数不变
A.①②③B.①③⑤C.③④⑤D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com