
在渔业生产中,有时需要异地运输鱼苗,为保证运输过程中鱼苗不死亡,必须满足下列条件:(1)水的pH要调在8~8.5之间;(2)防止细菌大量繁殖;(3)水中要溶有充足的氧气;(4)使鱼苗呼出的CO 2 气体及时排出。在长距离储运鱼苗的水中,最好加入下列物质中的
A.纯净的氧气 B.过氧化氢 C.过氧化钠 D.过氧化钙
科目:高中化学 来源:2015-2016学年山东省平度市高一上学期直升班抽考化学试卷(解析版) 题型:填空题
一定物质的量浓度硫酸铜溶液的配制。
①已知室温下饱和硫酸铜溶液的质量百分数为20%,密度为1.2g·cm-3,现要用这种饱和硫酸铜溶液来配制240mL 0.05 mol·L-1硫酸铜溶液,实验中需要用置筒量取饱和硫酸铜溶液___________mL。
②从下列选项中选出实验中不需要用到的仪器或用品___________(填序号)。
A 天平 B 100mL烧杯 C 10mL量筒 D 50mL量筒
E 100mL容量瓶 F 250mL容量瓶 G 玻璃棒
实验中还缺少的重要仪器是___________。
③下列操作将使所配溶液物质的量浓度偏高的是__________。
A.在量取饱和硫酸铜溶液时仰视读数
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:选择题
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗漏的电解液腐蚀其他物品
D.回收其中的石墨电极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省衡水市高一上第四次月考化学试卷(解析版) 题型:选择题
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2016届江西师大附中、临川一中高三上第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.非金属单质中一定存在共价键;
B.金属元素和非金属元素形成的化合物一定是离子化合物;
C.含共价键的化合物不一定是共价化合物;
D.溶于水能导电的化合物就是离子化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高一上12月月考化学试卷(解析版) 题型:选择题
有温度和容积均相同的两容器Ⅰ、Ⅱ,向Ⅰ中加入1 mol NO 2 ,Ⅱ中加入2 mol NO 2 ,都将发生反应2 NO 2 (g) N 2 O 4 (g),反应达到平衡时,测得Ⅰ中NO 2 的转化率为a%,Ⅱ中NO 2 的转化率为b%,则a、b的关系为
N 2 O 4 (g),反应达到平衡时,测得Ⅰ中NO 2 的转化率为a%,Ⅱ中NO 2 的转化率为b%,则a、b的关系为
A.a<b B.a>b C.a=b D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北大名县一中高一上学期第二次月考化学试卷(解析版) 题型:选择题
关于胶体和溶液的本质区别,下列叙述中正确的
A.溶液呈电中性,胶体带电荷
B.溶液中通过一束光线出现明显光路,胶体中通过一束光线没有特殊现象
C.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
D.溶液与胶体的本质区别在于分散质微粒直径大小,前者小于1nm,后者介于1nm~100nm之间
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期12月月考化学试卷(教师版) 题型:选择题
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成的混合溶液。下列有关推断正确的是
A.若HA的电离能力大于A-的水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若A-的水解能力大于HA的电离能力,则有c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源:2016届浙江省金丽衢十二校高三上学期第一次联考化学试卷(解析版) 题型:填空题
中科院大连化学物理研究所的“煤基甲醇制取低碳烯烃技术(简称DMTO)”荣获2014年度国家技术发明一等奖。DMTO技术主要包括煤的气化、液化、烯烃化三个阶段,相关反应的热化学方程式如下:
(i)煤气化制合成气:C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
(ii)煤液化制甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(iii)甲醇制取低碳烯烃:2CH3OH(g) C2H4(g)+2H2O(g) ΔH= -11.72kJ·mol-1……(a)
C2H4(g)+2H2O(g) ΔH= -11.72kJ·mol-1……(a)
3CH3OH(g) C3H6(g)+3H2O(g) ΔH= -30.98kJ·mol-1……(b)
C3H6(g)+3H2O(g) ΔH= -30.98kJ·mol-1……(b)
回答下列问题:
(1)已知:C(s)+CO2(g)=2CO(g) ΔH= +172.5kJ·mol-1,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= -41.0kJ·mol-1
反应(i)能自发进行的条件是 (填“高温”、“低温”或“任何温度”)。
(2)反应(ii)中以氢碳[n(H2)∶n(CO)]投料比为2制取甲醇,温度、压强与CO的平衡转化率关系如下图1。
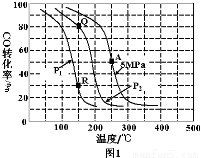
①对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则A点时反应(ii)的Kp= (保留两位有效数字,分压=总压×物质的量分数)。
②比较P1 P2,Kp(Q) Kp(R)(填“大于”、“小于”或“等于”)。
③工业上常以铜基催化剂,压强5MPa,温度275℃下发生反应(ii),CO转化率可达到40%左右。为提高CO转化率除了可以适当改变反应温度和压强外,还可以采取的措施有 (写出2个)。
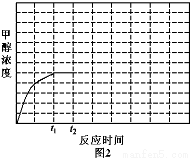
④若反应(ii)在恒容密闭容器内进行,T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t2时刻迅速降温到T2,t3时刻体系重新达到平衡。试在图中画出t2时刻后甲醇浓度随时间变化趋势图(在图中标出t3)。
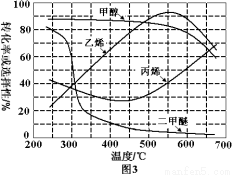
(3)烯烃化阶段:在常压和某催化剂作用下,甲醇的平衡转化率及乙烯、丙烯等物质的选择性(指除了水蒸气以外的产物中乙烯、丙烯等物质的物质的量分数)与反应温度之间的关系如图3。为尽可能多地获得乙烯,控制反应温度为550℃的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com