
|
100℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述错误的是 | |
| [ ] | |
A. |
此时水的离子积KW=1.0×10-14 |
B. |
水电离出的[H+]=1.0×10-10 mol/L |
C. |
水的电离度随温度升高而增大 |
D. |
[H3O+]>[SO2-4] |
科目:高中化学 来源:河北省衡水中学2011-2012学年高二上学期一调考试化学试题 题型:021
|
100℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述不正确的是 | |
A. |
此时水的离子积KW=1.0×10-14 |
B. |
水电离出的c(H+)=1.0×10-10 mol/L |
C. |
水的电离度随温度升高而升高 |
D. |
c(H3O+)>c(SO42-) |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第19期 总第175期 人教课标版(选修4) 题型:013
|
下列表述都与水的电离有关,其中正确的是 | |
| [ ] | |
A. |
常温下, pH=12的Ba(OH)2溶液与0.01 mol/L H2SO4溶液中H2O的电离程度相同 |
B. |
t℃时,某溶液的pH=6,则该溶液一定为酸性 |
C. |
在 0.1 mol/L的氢溴酸中加入适量的蒸馏水,溶液的c(OH-)减小 |
D. |
100℃时,向pH=6的蒸馏水中加入NaHSO4晶体后测得溶液的pH=2,则H2O电离出的c(H+)=1×10-10 mol/L |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:计算题
铁及其化合物在国民经济的发展中起着重要作用。

(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O= TiO2+(无色)+Fe2++2H+
③ 。
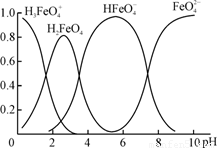
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高二下学期第一次月考化学试卷(解析版) 题型:选择题
能使水的电离平衡正向移动,而且所得溶液呈酸性的是
A.将水加热到100 ℃时,水的pH=6 B.向水中滴加少量稀H2SO4
C.向水中加入少量NaHCO3 D.向水中加入少量胆矾晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com