
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A. 17g甲基(—l4CH3)中所含中子数为9NA
B. 28g乙烯和丙烯中的C原子数目为2NA
C. 300mL 2mol/L蔗糖溶液中含分子数为0.6NA
D. 标况下,1.12 L CC14含有的氯原子数为0.2NA
【答案】B
【解析】
A项,—14CH3的摩尔质量为17g/mol,17g—14CH3的物质的量为17g![]() 17g/mol=1mol,1个—14CH3中含8个中子,17g—14CH3中含中子物质的量为8mol,所含中子数为8NA,A项错误;
17g/mol=1mol,1个—14CH3中含8个中子,17g—14CH3中含中子物质的量为8mol,所含中子数为8NA,A项错误;
B项,乙烯、丙烯的分子式分别为C2H4、C3H6,实验式都是CH2,28g乙烯和丙烯中所含“CH2”物质的量为28g![]() 14g/mol=2mol,所含碳原子物质的量为2mol,所含碳原子数为2NA,B项正确;
14g/mol=2mol,所含碳原子物质的量为2mol,所含碳原子数为2NA,B项正确;
C项,n(蔗糖)=2mol/L![]() 0.3L=0.6mol,300mL2mol/L蔗糖溶液中含蔗糖分子数为0.6NA,在蔗糖溶液中还存在大量的水分子,300mL2mol/L蔗糖溶液中所含分子数大于0.6NA,C项错误;
0.3L=0.6mol,300mL2mol/L蔗糖溶液中含蔗糖分子数为0.6NA,在蔗糖溶液中还存在大量的水分子,300mL2mol/L蔗糖溶液中所含分子数大于0.6NA,C项错误;
D项,CCl4呈液态,无法用22.4L/mol计算1.12LCCl4物质的量,D项错误;
答案选B。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下图,下列说法错误的是( )
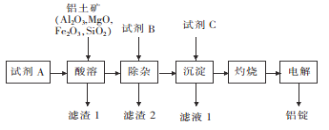
已知:滤渣2主要成分是Mg(OH)2、Fe(OH)3。
A. 试剂A可以是稀硫酸或盐酸B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2D. 试剂C应是NH3或氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B. 当A接电源的正极时,此时Li+脱离离子存储层
C. 当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.SO2可用于漂白纸浆和草帽
B.Fe2O3可用作红色油漆和涂料
C.活性炭可用于去除冰箱中的异味
D.根据是否产生丁达尔效应,将分散系分为溶液,浊液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A.常温下金属单质都是固体
B.金属单质都能和稀硫酸反应产生氢气
C.金属单质在化学反应中只作还原剂
D.金属元素在自然界中都是以化合态存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述正确的是( )
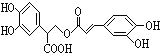
A. 迷迭香酸属于芳香烃
B. 迷迭香酸含有五种官能团
C. 1mol迷迭香酸最多能和7mol溴水发生反应
D. 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为________________________;
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.CO2与乙醇的浓度之比不再改变
b.单位时间内消耗H2和CO2的物质的量之比为3∶1
c.H2的体积分数保持不变
d.混合气体的平均相对分子质量不再改变

(3)在一定压强下,测得由CO2制取乙醇的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据分析:
①升高温度,平衡向________(正或逆)反应方向移动。
②在700 K、起始投料比![]() =1.5时,H2的体积分数为________(保留小数点后一位)。
=1.5时,H2的体积分数为________(保留小数点后一位)。
③在500 K、起始投料比![]() =2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
=2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
Ⅱ 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(可逆反应,用化学方程式表示)________________________________,且汽缸内温度越高,单位时间内NO排放量越大,试分析其原因____________________。

(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
①计算实验Ⅱ从开始至达到平衡时的反应速率v(NO)=________________。
②图中三组实验从开始至达到平衡时的反应速率v(NO)由小到大的顺序为________(填序号)。
③与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为:实验Ⅰ_______________________________;实验Ⅲ_______________________。
④三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)、αⅢ(CO)的大小关系为______________。判断依据为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:

(1)碳元素在周期表中的位置是______________。
(2)将硅的元素符号填写在上述周期表相应的空格中。________
(3)在上述周期表中,用实线画出周期表的上方边界。_______
(4)第118号元素为Og(中文名“![]() ”,ào),下列说法不正确的是____。
”,ào),下列说法不正确的是____。
a.Og是第七周期0族元素
b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强
d.中子数为179的Og核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取其工艺流程如图所示.
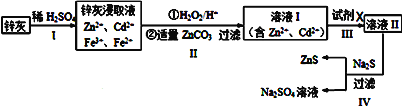
(1)步骤Ⅱ所得滤渣中的物质是(写化学式)_____________。
(2)步骤II中的氧化还原反应的离子方程式为___________________________________。
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为__________________________。
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:
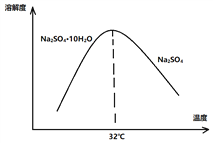
从滤液中得到Na2SO4的操作方法是_________________________________。
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 molL-1时,Mn2+开始沉淀,则a=____________。[已知:H2S 的电离常数Ka1=1.310 -7,Ka2=7.010 -15;Ksp(MnS)=1.410 -15]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com