
 ������ѧ֪ʶ������������⣺
������ѧ֪ʶ������������⣺
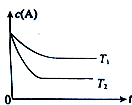
���� ��1���¶�Խ�ߴ�ƽ�������ʱ��Խ�̣�Ȼ����ͼ�������Ӧ����ЧӦ���Ӷ��ó�K�ı仯�����
��2����������ʽ�����ƽ�ⳣ���ͷ�Ӧ���ʵĹ�ʽ����⣮
��3����ѧ��Ӧ�ɼ����������������¼������ͷ���������Ӧ�ʱ����ֵ�����������IJ�ֵ��
��4����ȼ�ϵ���У���������ȼ�Ϸ���ʧ���ӵ�������Ӧ��
��� �⣺��1����ͼ��֪T2�ȴ�ƽ��״̬������T1С��T2�����¶�Խ��KԽС����������ӦΪ���ȷ�Ӧ�������¶�Խ��KֵԽ�ʴ�Ϊ��С�ڣ�С�ڣ�
��2��A��g��?B��g��+C��g��
��ʼŨ�ȣ�0.050 0 0
�仯Ũ�ȣ�0.035 0.035 0.035
ƽ��Ũ�ȣ�0.015 0.035 0.035
��ƽ��ʱ��ϵ�ܵ����ʵ���Ϊ=��0.015+0.035+0.035����1=0.085mol��
��K=$\frac{0.035��0.035}{0.015}$=0.082��
�۷�Ӧ��0��5min�����ƽ����Ӧ����v��A��=$\frac{0.035mol/L}{5min}$=0.007mol/��L•min����
�ʴ�Ϊ��0.085mol��0.082��0.007mol/��L•min����
��3����Ӧ�ȵ��ڷ�Ӧ����ܼ��ܼ�ȥ��������ܼ��ܣ�����N2��g��+3H2��g��?2NH3��g����H=-92.2kJ•mol-1����N-H����Ϊ xKJ/mol����945.8kJ/mol+3��436kJmol-6xkJ/mol=-92.2kJ/mol���x=391���ʴ�Ϊ��391��
��4��������������ȼ�ϵ�ص�ȼ�ϣ����ݵ�ط�Ӧ��4NH3+3O2�T2N2+6H2O����ȼ�ϵ�صĸ�������ȼ�ϰ�������ʧ���ӵ�������Ӧ����缫��Ӧ2NH3-6e-+6OH-=N2+6H2O���ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
���� ���⿼���˻�ѧ��Ӧ�����仯����ѧƽ��Ӱ�����صķ����жϣ�ͼ������뻯ѧƽ��ļ���Ӧ�ã�Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬��Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡɽһ�����ϵڶ���ͳ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A��18 g D2O��18 g H2O�к��е���������Ϊ10NA
B��14 g CO��C2H4���������11.2 L N2�����еķ���������0.5NA
C������������ˮ��Ӧʱ������0.1 mol����ת�Ƶĵ�����Ϊ0.2NA
D���ܱ�������2 mol NO��1 mol O2��ַ�Ӧ������ķ�����Ϊ2NA
�鿴�𰸺ͽ���>>
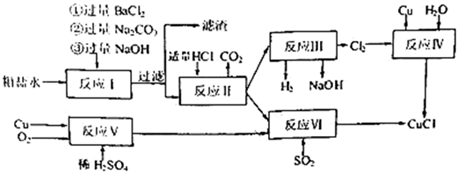
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
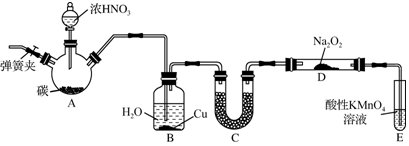
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
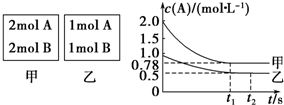
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯī | B�� | �������� | C�� | п | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
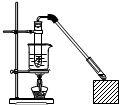 ������Ҵ���Ӧ��װ����ͼ��ʾ�����Թ������3mL�Ҵ���Ȼ��һ��ҡ����һ�������ؼ���2mLŨ�����2mL�����ᣬ�þƾ���С�ľ��ȵؼ���10min����������������������ͨ�뵽����̼������Һ��Һ���ϣ�
������Ҵ���Ӧ��װ����ͼ��ʾ�����Թ������3mL�Ҵ���Ȼ��һ��ҡ����һ�������ؼ���2mLŨ�����2mL�����ᣬ�þƾ���С�ľ��ȵؼ���10min����������������������ͨ�뵽����̼������Һ��Һ���ϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
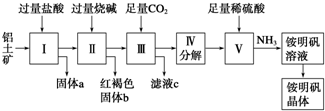
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���¶ȣ��棩 | ��20 | ��40 | ��60 | ��100 |
| ���ܽ�ȣ�g�� | ��5.0 | ��8.7 | ��14.8 | ��40.2 |
| ������������ | ��Fe��OH��3 | ��Al��OH��3 | ��Fe��OH��2 | ��Mg��OH��2 |
| ��pH | ��3.2 | ��5.2 | ��9.7 | ��12.4 |
| ��ѧʽ | H2CO3 | HF |
| ���볣�� | K1=4.4��10-7 K2=4.7��10-11 | K=6.75��10-4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com