
| A. | 燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| B. | 工业上用点燃H2、Cl2混合气体的方法生产盐酸 | |
| C. | 金属钠着火时可用干燥的沙土来灭火 | |
| D. | 驰名世界的中国瓷器是硅酸盐材料 |
分析 A.根据燃烧热的定义判断;
B.点燃H2、Cl2混合气体易爆炸;
C.钠、过氧化钠易与水、二氧化碳反应;
D.陶瓷的主要原料为硅酸盐.
解答 解:A.由燃烧热的定义可知,燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,故A正确;
B.点燃H2、Cl2混合气体易爆炸,工业制备盐酸,应用氢气在氯气中燃烧,但二者不能混合后再点燃,故B错误;
C.钠燃烧生成过氧化钠,且钠、过氧化钠易与水、二氧化碳反应,一般用沙土扑灭,故C正确;
D.在无机非金属材料中,硅及其化合物是密切联系生产生活的一类重要物质,陶瓷、玻璃、水泥等都是硅酸盐产品属于硅酸盐材料,故D正确.
故选B.
点评 本题考查较为综合,涉及燃烧热、氯气、钠的性质以及硅酸盐等知识,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 阳离子只具有氧化性,阴离子只具有还原性 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 物质在反应中失去电子数越多,其还原性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
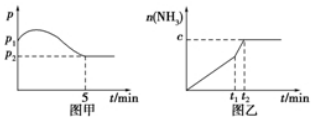
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)→C(金刚石)△H=+73 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘的CCl4溶液呈紫红色 | |
| B. | 碘在CCl4中的溶解度比在水中的溶解度大 | |
| C. | 萃取时,要充分振荡混合液体并适当旋转活塞排气减压 | |
| D. | 分液时,水从分液漏斗下口流出,碘的CCl4溶液从漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- | |
| D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
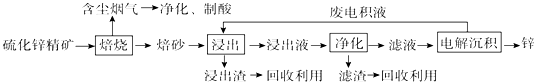
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com